OGT
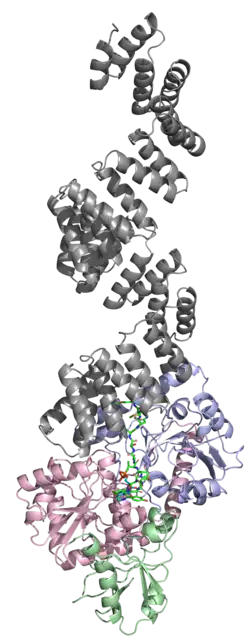
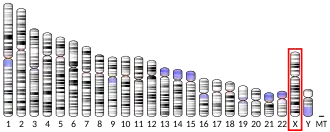
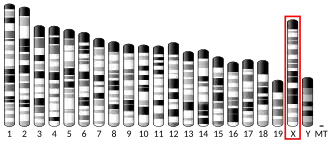
OGT (англ., O-linked N-acetylGlucosamine Transferase) — ген, кодирующий гликозилтрансферазу OGT (EC 2.4.1.255). Фермент OGT гликозилирует белки, катализируя образование O-гликозидной связи между N-ацетилглюкозамином (GlcNAc) и остатками серина или треонина. В качестве источника GlcNAc-группы фермент OGT использует УДФ-N-ацетилглюкозамин[5]. Среди мишеней фермента OGT — множество различных белков, включая метилтрансферазу MLL5, гистон H2B, тау-белок, корегулятор транскрипции HCFC1, киназы AKT1 и PFKL[6]. Для гена OGT обнаружены альтернативно сплайсированные варианты транскриптов, кодирующие различные изоформы фермента. Одна из изоформ белка OGT (∼90 кДа) локализуется в митохондрии, а две других (78 и 110 кДа) — в цитоплазме и ядре клетки[7]. У человека ген OGT находится на длинном плече X-хромосомы (Xq13)[8]; описано несколько точечных мутаций в гене OGT, которые связывают со слабоумием и задержкой развития[9]. Аминокислотная последовательность белка, кодируемого геном OGT, является высококонсервативной в филогенетическом ряду от червей до человека. Нокаут гена OGT у млекопитающих является эмбриолетальным[10].
Особенности O-ацетилглюкозаминирования
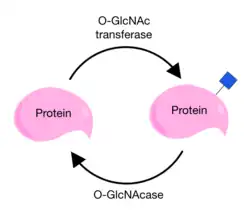
Мишенью для O-ацетилглюкозаминирования служат белки, которые остаются в цитоплазме или в клеточном ядре. Это отличает данную модификацию от гликозилирования с N-ацетилгалактозамином (O-GalNAc), мишенью которой служат секретируемые белки[11]. O-ацетилглюкозаминирование является динамической модификацией: в клетке существует баланс между O-ацетилглюкозаминированием белка-мишени с помощью гликозилтрансферазы OGT и удалением N-ацетилглюкозамина при помощи ядерно-цитоплазматической β-N-ацетилглюкозаминидазы OGA (O-GlcNAcase; OGA; EC 3.2.1.169)[12][13]. По динамическому характеру O-ацетилглюкозаминирование похоже на фосфорилирование белков, которое также является обратимой модификацией. Однако в O-ацетилглюкозаминировании белков непосредственно участвуют только два специализированных фермента, в то время как в фосфорилировании участвуют сотни киназ и дефосфорилаз[14].O-ацетилглюкозаминирование и фосфорилирование может проходить по одним и тем же сериновым или треониновым аминокислотным остаткам, что заставляет предположить, что эти модификации могут конкурировать друг с другом в клетке[12][15]. O-ацетилглюкозаминирование влияет на клеточный цикл, стабильность белков, участвует в ответе на стресс. Данная модификация может играть роль в таких нейродегенеративных заболеваниях, как болезнь Паркинсона и болезнь Альцгеймера[16][15]. Обнаружено, что эта модификация играет роль в диабете[17]. Также O-GlcNAc-гликозилирование может способствовать эффекту Варбурга, наблюдаемому в раковых клетках[12][18].
Примечания
- 1 2 3 GRCh38: Ensembl release 89: ENSG00000147162 - Ensembl, May 2017
- 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000034160 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Lubas W. A., Frank D. W., Krause M., Hanover J. A. O-Linked GlcNAc transferase is a conserved nucleocytoplasmic protein containing tetratricopeptide repeats (англ.) // The Journal of Biological Chemistry : journal. — 1997. — April (vol. 272, no. 14). — P. 9316—9324. — doi:10.1074/jbc.272.14.9316. — PMID 9083068.
- ↑ UniProtKB - O15294 (OGT1_HUMAN) (англ.). https://www.uniprot.org. Дата обращения: 18 апреля 2020. Архивировано 14 августа 2020 года.
- ↑ Zachara N., Akimoto Y., Hart G. W. The O-GlcNAc Modification // Essentials of Glycobiology. 3rd edition. (англ.) / A. Varki , R. D. Cummings , J. D. Esko et al.. — Cold Spring Harbor Laboratory Press, 2017. — P. 823. — ISBN 978-1-621821-32-8.
- ↑ Entrez Gene: OGT O-linked N-acetylglucosamine (GlcNAc) transferase (UDP-N-acetylglucosamine:polypeptide-N-acetylglucosaminyl transferase).
- ↑ Pravata V. M. et al. An intellectual disability syndrome with single-nucleotide variants in O-GlcNAc transferase (англ.) // European Journal of Human Genetics. — 2020. — Vol. 28. — P. 706-714. — doi:10.1038/s41431-020-0589-9. Архивировано 26 апреля 2021 года.
- ↑ Shafi R. et al. The O-GlcNAc transferase gene resides on the X chromosome and is essential for embryonic stem cell viability and mouse ontogeny (англ.) // Proceedings of the National Academy of Science. — 2000. — Vol. 97, no. 11. — P. 5735-5739. — doi:10.1073/pnas.100471497.
- ↑ Yang, Xiaoyong; Qian, Kevin. Protein O-GlcNAcylation: emerging mechanisms and functions (англ.) // Nature Reviews Molecular Cell Biology : journal. — 2017. — Vol. 18. — P. 452—465. — doi:10.1038/nrm.2017.22. — PMID 28488703. — PMC 5667541.
- 1 2 3 Varki, Ajit. Essentials of glycobiology. — 3rd. — Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press, 2015. — ISBN 9781621821328.
- ↑ G. Spiro, Robert. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds (англ.) // Glycobiology : journal. — 2002. — Vol. 12, no. 4. — P. 43R-56R. — doi:10.1093/glycob/12.4.43R. — PMID 12042244.
- ↑ B. Lazarus, Michael; Jiang, Jiaoyang; Kapuria, Vaibhav; Bhuiyan, Tanja; Janetzko, John; F. Zandberg, Wesley; J. Vocadlo, David; Herr, Winship; Walker, Suzanne. HCF-1 is Cleaved in the Active Site of O-GlcNAc Transferase (англ.) // Science : journal. — 2013. — Vol. 342, no. 6163. — P. 1235—1239. — doi:10.1126/science.1243990. — PMID 24311690. — PMC 3930058.
- 1 2 W. Hart, Gerald; Slawson, Chad; Ramirez-Correa, Genaro; Lagerlof, Olof. Cross Talk Between O-GlcNAcylation and Phosphorylation: Roles in Signaling, Transcription and Chronic Disease (англ.) // Annual Review of Biochemistry : journal. — 2011. — Vol. 80, no. 1. — P. 825—858. — doi:10.1146/annurev-biochem-060608-102511. — PMID 21391816. — PMC 3294376.
- ↑ Van den Steen, Philippe; M. Rudd, Pauline; A. Dwek, Raymond; Opdenakker, Ghislain. Concepts and Principles of O-Linked Glycosylation (англ.) // Critical Reviews in Biochemistry and Molecular Biology : journal. — 1998. — Vol. 33, no. 3. — P. 151—208. — doi:10.1080/10409239891204198. — PMID 9673446.
- ↑ Ma, Junfeng; W. Hart, Gerald. Protein O-GlcNAcylation in diabetes and diabetic complications (англ.) // Expert Review of Proteomics : journal. — 2014. — Vol. 10, no. 4. — P. 365—380. — doi:10.1586/14789450.2013.820536. — PMID 23992419. — PMC 3985334.
- ↑ Muniz de Quieroz, Rafaela; Carvalho, Erika; Barbosa Dias, Wagner. O-GlcNAcylation: the sweet side of the cancer // Frontiers in Oncology. — 2014. — Т. 4. — С. 132. — doi:10.3389/fonc.2014.00132.