Гидроксид таллия(I)
| Гидроксид таллия(I) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гидроксид таллия |
| Традиционные названия | Гидроокись таллия |
| Хим. формула | TlOH |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 221,39 г/моль |
| Плотность | 7,44 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | разл. 125 °C |
| Мол. теплоёмк. | 47,3 Дж/(моль·К) |
| Энтальпия | |
| • образования | -238,9 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
25,4 (0°C) 34,3 (18°C) 40,3 (30°C) 49,5 (40°C) 79,6 (65°C) 126,1 (90°C) 149 (100°C) |
| • в этаноле | растворим |
| Классификация | |
| Рег. номер CAS | 12026-06-1 |
| PubChem | 160963 |
| Рег. номер EINECS | 234-708-8 |
| SMILES | |
| InChI | |
| ChemSpider | 141413 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид таллия — неорганическое соединение, гидроксид металла таллия с формулой TlOH, жёлтые кристаллы, хорошо растворимые в воде. Относят к щёлочам. Очень ядовит, как и все растворимые в воде соединения таллия, проявляет сильные основные свойства, несмотря на то что таллий относится не к щёлочным, не к щёлочноземельным, а к постпереходным металлам.
Получение
- Растворение закиси таллия в воде:
- Обменными реакциями:
- Взаимодействие оксида таллия(III) с пероксидом водорода:
Физические свойства
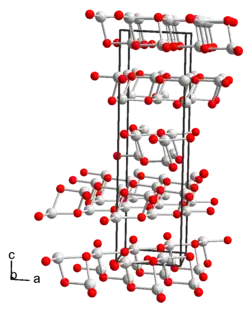
Гидроксид таллия образует жёлтые кристаллы моноклинной сингонии, параметры ячейки a = 2,120 нм, b = 0,6240 нм, c = 0,5950 нм, β = 91,65°, Z = 16.
Хорошо растворяется в воде, образует щёлочной раствор. Таллий — единственный металл, не относящийся к щёлочным и щёлочноземельным, гидроксид которого обладает аналогичными свойствами сильного основания.
Химические свойства
- В воде диссоциирует подобно гидроксидам щёлочных металлов (за исключением сильноосновных растворов):
- При нагревании разлагается:
- Реагирует с кислотами:
- При нагревании окисляется кислородом:
- Из воздуха поглощает углекислый газ:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
