Нитрат таллия(I)
| Нитрат таллия(I) | |
|---|---|
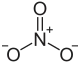 | |
| Общие | |
| Систематическое наименование |
Нитрат таллия(I) |
| Традиционные названия | Азотнокислый таллий |
| Хим. формула | TlNO3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 266,37 г/моль |
| Плотность | 5,556 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 206,5; 208 °C |
| Мол. теплоёмк. | 99,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | −243,9 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 9,5520; 11180 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10102-45-1 |
| PubChem | 24937 и 16693918 |
| Рег. номер EINECS | 233-273-1 |
| SMILES | |
| InChI | |
| ChemSpider | 23311 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т та́ллия(I) (мононитра́т та́ллия, таллонитрат) — неорганическое соединение, соль металла таллия и азотной кислоты с формулой TlNO3, бесцветные кристаллы, хорошо растворимые в воде.
Получение
- Растворение в разбавленной азотной кислоте таллия:
- или гидроксида таллия(I):
Физические свойства
Нитрат таллия образует бесцветные кристаллы ромбической сингонии, пространственная группа P bnm, параметры ячейки a = 0,6287 нм, b = 1,231 нм, c = 0,8001 нм, Z = 8. При кристаллизации из водных растворах при температуре выше 143,5 °C образуются кристаллы кубической сингонии, параметры ячейки a = 0,4322 нм, Z = 1.
Хорошо растворяется в воде, причём растворимость резко возрастает при повышении температуры, нерастворим в этиловом спирте. Молярная масса составляет 266,37 г/моль, плотность 5,56 г/см³, плавится при 208 °C[1][2].
Химические свойства
- При нагревании разлагается:
- Вступает в обменные реакции:
- Концентрированной азотной кислотой окисляется до нитрата таллия(III)[3]:
Применение
Применяется в электронной микроскопии для окрашивания препаратов с целью повышения контрастности изображения. В аналитической химии для проведения анализов металлов, в частности золота, урана, платины и других, также может использоваться для проведения анализа на наличие иода в присутствии хлора[2].
Токсичность
Нитрат таллия(I) ядовит, при попадании в организм происходит поражение желудочно-кишечного тракта, почек и центральной нервной системы[2].
См. также
Примечания
- ↑ Федоров, 1995.
- 1 2 3 Фрайштат, 1980, с. 378—379.
- ↑ Лидин, 2000, с. 96.
Литература
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Федоров П. И. Таллий // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 490—492. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Фрайштат Д. М. Реактивы и препараты для микроскопии. — М.: Химия, 1980. — 480 с.