Иодид олова(II)
| Иодид олова(II) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Иодид олова |
| Традиционные названия | Иодистое олово |
| Хим. формула | SnI2 |
| Рац. формула | SnI2 |
| Физические свойства | |
| Состояние | красные кристаллы |
| Молярная масса | 372,50 г/моль |
| Плотность | 5,19; 5,28 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 320 °C |
| • кипения | 712; 717; 720 °C |
| Энтальпия | |
| • образования | -145,2 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,9820; 4,03100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10294-70-9 |
| PubChem | 25138 и 9951390 |
| Рег. номер EINECS | 233-667-3 |
| SMILES | |
| InChI | |
| ChemSpider | 23483 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Иоди́д о́лова(II) (дииоди́д о́лова, двухио́дистое о́лово) — неорганическое соединение, соль металла олово и иодистоводородной кислоты с формулой SnI2, красные кристаллы, слабо растворимые в воде (с разложением), образует кристаллогидраты. Восстановитель.
Получение
- Нагревание иодида олова(IV) с металлическим оловом:
- Растворение оловянной фольги в горячем концентрированном растворе иодоводорода:
- Взаимодействие раствора иодида калия с горячим концентрированным раствором хлорида олова:
Физические свойства
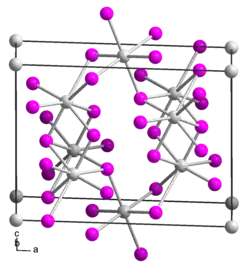
Иодид олова(II) образует красно-оранжевые кристаллы моноклинной сингонии, пространственная группа C m, параметры ячейки a = 1,429 нм, b = 0,453 нм, c = 1,072 нм, β = 92°, Z = 6
Плохо растворяется в воде, бензоле, хлороформе и четырёххлористом углероде, растворяется в метаноле.
С аммиаком образует аддукты вида SnI2·n NH3, где n = 1, 2, 3, 4, 5 и 9.
Из подкисленных растворов (HI) выделяются кристаллогидраты SnI2·H2O и SnI2·2H2O.
Химические свойства
- В водных растворах подвергается гидролизу:
- Из охлаждённых растворов с избытком HI выделяется трииодооловянистая кислота:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.