Иодид стронция
| Иодид стронция | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Иодид стронция |
| Традиционные названия | Иодистый стронций |
| Хим. формула | SrI2 |
| Рац. формула | SrI2 |
| Физические свойства | |
| Состояние | Бесцветные гигроскопические кристаллы |
| Молярная масса | 341,43 г/моль |
| Плотность | 4,549 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 507 °C |
| • кипения | 1773 °C[1] |
| Мол. теплоёмк. | 77,40 Дж/(моль·К) |
| Энтальпия | |
| • образования | -562 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 17820; 380100 г/100 мл |
| • в этаноле | 4,539 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10476-86-5 |
| PubChem | 25304, 5360352 и 139046539 |
| Рег. номер EINECS | 233-972-1 |
| SMILES | |
| InChI | |
| RTECS | WK9275000 |
| ChemSpider | 23637 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Иодид стронция — бинарное неорганическое соединение стронция и иода с формулой SrI2. Бесцветные гигроскопичные кристаллы. Образует несколько кристаллогидратов.
Получение
- Вещество получают действуя иодистого водорода на оксид стронция, его гидроксид или карбонат:
Физические свойства
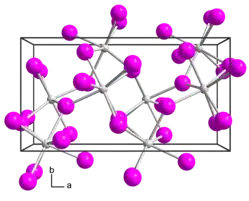
Иодид стронция образует бесцветные диамагнитные кристаллы ромбической сингонии, пространственная группа P bca, параметры ячейки a = 1,522 нм, b = 0,82 нм, c = 0,790 нм, Z = 8. При кристаллизации из водных растворов образуются кристаллогидраты SrI2•6H2O, SrI2•2H2O и SrI2•H2O.
Из неводных растворов выделены разнообразные сольваты, например SrI2•n NH3 (где n = 6, 2, 1).
Химические свойства
- Кристаллогидрат при нагревании теряет воду:
- Иодид стронция с иодом образует неустойчивые полииодиды:
Применение
- Иодид стронция используется как оптический материал.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Примечания
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
