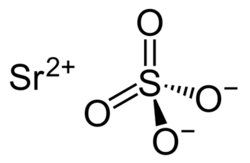
Сульфат стронция
| Сульфат стронция | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | SrSO4 | ||
| Рац. формула | SrSO4 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 183,68 г/моль | ||
| Плотность | 3,96 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | (давление 6МПа) 1606 °C | ||
| • разложения | 1580 °C[1] | ||
| Энтальпия | |||
| • образования | −1453,1 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | 7759-02-6 | ||
| PubChem | 3084026 и 139207728 | ||
| Рег. номер EINECS | 231-850-2 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 2341151 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Сульфат стронция, сернокислый стронций SrSO4 — стронциевая соль серной кислоты. Встречается в природе в виде минерала целестина.
Получение
- Из природного сырья — встречается в виде минерала целестин
- Реакцией сульфата натрия с водорастворимыми солями стронция
Физические свойства
Бесцветные кристаллы ромбической сингонии (α-модификация, существует до 1157 °C). При высоких температурах переходит в гексагональную β-модификацию.
Малорастворим в воде (Произведение растворимости составляет ), в присутствии хлорида стронция растворимость повышается.
Плавится только при высоких давлениях, при 6МПа температура плавления равна 1606 °C.
Химические свойства
- Разлагается при температурах выше 1580 °C:
- С концентрированной серной кислотой переходит в гидросульфат:
- Вступает в обменные реакции. К примеру, с растворимыми карбонатами образует осадок карбоната стронция:
Применение
- Наполнитель для резины и красок.
- Добавка в электролит при скоростном хромировании.
- Входит в состав тяжёлых жидкостей для бурения скважин.
В природе
Примечания
- ↑ Strontiumsulfat
- ↑ Лидин, 2000, с. 67.
- ↑ под ред. В. Вестхайде и Р. Ригера. Зоология беспозвоночных в двух томах. — М., 2008.
Литература
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.