Окисление по Оппенауэру
Окисление Оппенауэра, названное в честь Руперта Виктора Оппенауэра, представляет собой щадящий метод селективного окисления вторичных спиртов в кетоны[1].
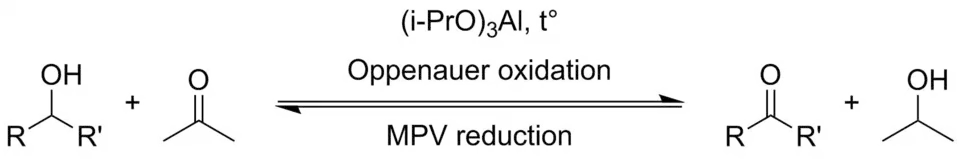
Реакция является обратной реакции восстановления Меервейна-Понндорфа-Верлея[2]. Спирт окисляют изопропоксидом алюминия в избытке ацетона. Это смещает равновесие в сторону продукта.
Окисление является высокоселективным для вторичных спиртов и не окисляет другие чувствительные функциональные группы, такие как амины и сульфиды[3]. Хотя первичные спирты можно окислять в условиях Оппенауэра, первичные спирты редко окисляются этим методом из-за конкурирующей альдольной конденсации альдегидов. Окисление Оппенауэра до сих пор используется для окисления субстратов восприимчивых к кислотах. Метод был в значительной степени вытеснен методами окисления на основе хроматов (например, хлорхромата пиридиния) или диметилсульфоксида (например, окисление Сверна) или окисление Десса-Мартина из-за использования относительно мягких и нетоксичных реагентов (например, реакция проводится в смесях ацетона и бензола). Окисление Оппенауэра широко используется в различных промышленных процессах, таких как синтез стероидов, гормонов, алкалоидов, терпенов и т. д.
Механизм
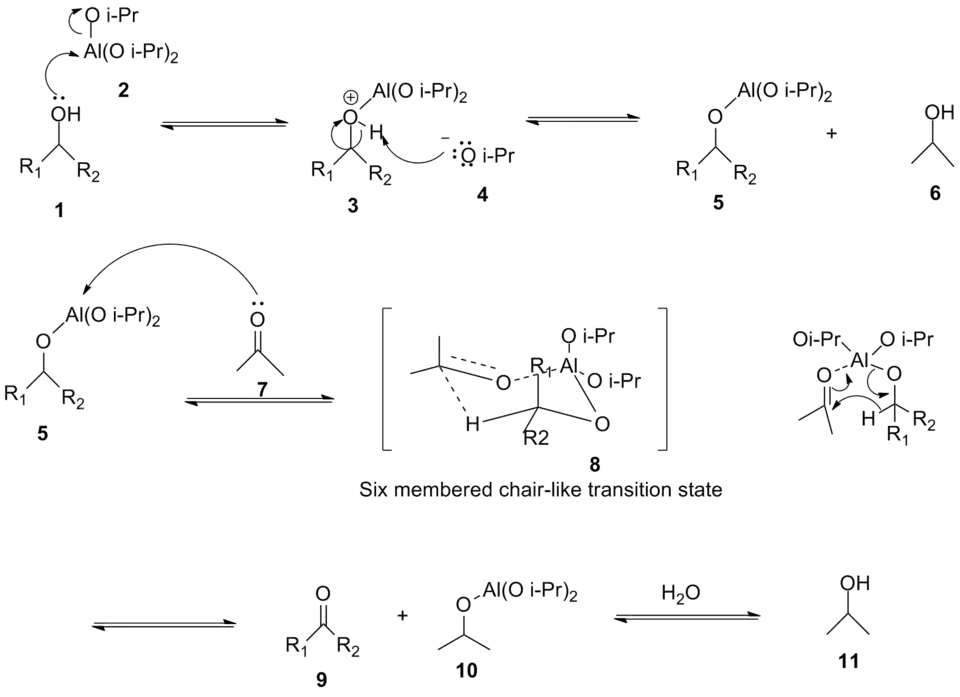
Механизм окисления Оппенауэра
На первом этапе этого механизма спирт (1) координируется с алюминием, образуя комплекс (3), который затем на втором этапе депротонируется алкоголят-ионом (4) с образованием промежуточного алкоголята(5). На третьем этапе окислитель ацетон (7) и субстрат спирт связываются с алюминием. Ацетон координируется с алюминием, который активирует его для перехода гидрида из алкоголята. Катализируемый алюминием гидридный сдвиг от α-углерода спирта к карбонильному углероду ацетона происходит через шестичленное переходное состояние (8). Желаемый кетон (9) образуется после переноса гидрида[4].
Преимущества
Преимуществом метода окисления по Оппенауэру является использование относительно недорогих и нетоксичных реагентов. Условия реакции мягкие и щадящие, поскольку субстраты обычно нагревают в смесях ацетона и бензола. Еще одним преимуществом окисления по Оппенауэру, которое делает его уникальным по сравнению с другими методами окисления, такими как хлорхромат пиридиния (PCC) и периодинан Десса-Мартина, является то, что вторичные спирты окисляются гораздо быстрее первичных спиртов, благодаря чему может быть достигнута хемоселективность. Кроме того, не происходит переокисления альдегидов в карбоновые кислоты в отличие от других методов окисления, таких как окисление Джонса[4].
Модификации
Реакция Веттштейна-Оппенауэра
В реакции Веттштейна-Оппенауэра, открытой Веттштейном в 1945 году, Δ5–3β-гидроксистероиды окисляются до Δ4,6-3-кетостероидов с бензохиноном в качестве акцептора водорода. Эта реакция полезна тем, что она позволяет получить Δ4,6-3-кетостероиды в один этап[5].
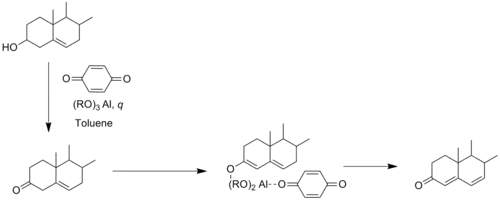
Реакция Веттштейна-Оппенауэра
Модификация Вудворда
В модификации Вудворда Вудворд заменил алкоголят алюминия на трет-бутоксид калия. Модификация Вудворда окисления Оппенауэра, также называемая окислением Оппенауэра–Вудворда, используется, когда определенные спиртовые группы не окисляются в стандартных условиях реакции Оппенауэра. Например, Вудворд использовал трет-бутоксид калия и бензофенон для окисления хинина в хининон, поскольку традиционная алюминиевая каталитическая система не могла окислить хинин из-за комплекса, образованного при координации азота с алюминиевым центром[6].
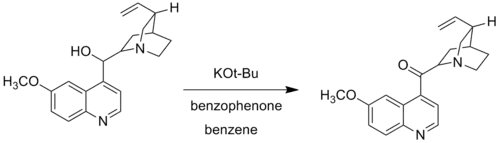
Модификация Вудворда
Другие модификации
Сообщалось также о нескольких модифицированных катализаторах на основе алкоголята алюминия. Например, Маруока и его коллеги сообщили о высокоактивном алюминиевом катализаторе, который использовался при окислении карвеола в карвон (член класса химических веществ, называемых терпеноидами) с превосходным выходом (94%)[7].
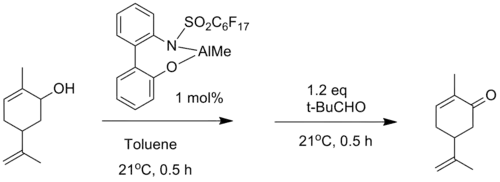
Модификация окисления Оппенауэра
В другой модификации катализатором является триметилалюминий, а в качестве окислителя используется альдегид 3-нитробензальдегид, например, при окислении изоборнеола в камфору[8].
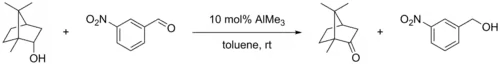
Модификация окисления Оппенауэра
Синтетические применение
Окисление Оппенауэра используется в фармацевтической промышленности для приготовления анальгетиков, таких как морфин и кодеин. Например, кодеинон получают путем окисления кодеина по Оппенауэру[9].
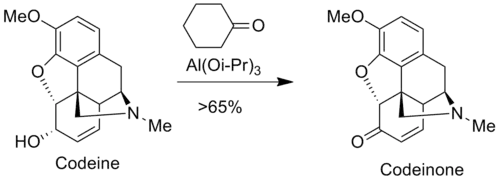
Окисление кодеина по Оппенауэру
Окисление Оппенауэра также используется для синтеза гормонов. Прогестерон получают путем окисления прегненолона по Оппенауэру[10].

Окисление прегненолона по Оппенауэру
Небольшая вариация окисления Оппенауэра также используется для синтеза производных стероидов. Например, эффективная каталитическая версия окисления Оппенауэра, в которой используется рутениевый катализатор, была разработана для окисления 5-ненасыщенных 3β-гидроксистероидов до соответствующего 4-ен-3-она[11].
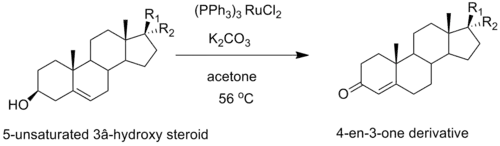
Окисление прегненолона по Оппенауэру
Окисление Оппенауэра также используется в синтезе лактонов из 1,4- и 1,5- диолов[12].

Окисление диола по Оппенауэру
Побочные реакции
Распространенной побочной реакцией окисления Оппенауэра является катализируемая основанием альдольная конденсация альдегидного продукта, который имеет α-атомы водорода, с образованием либо β- гидроксиальдегидов, либо α, β- ненасыщенных альдегидов[13].
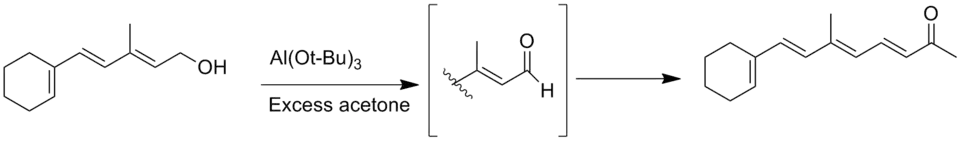
Окисление альдегида по Оппенауэру
Другая побочная реакция — реакция Тищенко альдегидных продуктов без α-водорода, но ее можно предотвратить, используя безводные растворители[4]. Другая общая побочная реакция – это миграция двойной связи при окислении субстратов аллилового спирта[14].
Примечания
- ↑ R. V. Oppenauer. Eine Methode der Dehydrierung von Sekundären Alkoholen zu Ketonen. I. Zur Herstellung von Sterinketonen und Sexualhormonen (англ.) // Recueil des Travaux Chimiques des Pays-Bas. — 1937-01. — Vol. 56, iss. 2. — P. 137–144. — ISSN 0165-0513. — doi:10.1002/recl.19370560206.
- ↑ Wilds, A. L. (1944). Reduction with Aluminum Alkoxides (The Meerwein-Ponndorf-Verley Reduction). Org. React. 2 (5): 178–223. doi:10.1002/0471264180.or002.05.
- ↑ Otvos, L.; Gruber, L.; Meisel-Agoston, J. (1965). The Meerwein-Ponndorf-Verley-Oppenauer. Investigation of the reaction mechanism with radiocarbon. Racemization of secondary alcohols. Acta Chim. Acad. Sci. Hung. 43: 149–153.
- 1 2 3 Corey, E.J. Strategic Applications of Named Reactions in Organic Synthesis / E.J Corey, Nicolaou, K.C.. — Elsevier, 2005. — ISBN 978-7-03-019190-8.
- ↑ Leon Mandell. The Mechanism of the Wettstein-Oppenauer Oxidation (англ.) // Journal of the American Chemical Society. — 1956-07. — Vol. 78, iss. 13. — P. 3199–3201. — ISSN 0002-7863. — doi:10.1021/ja01594a061.
- ↑ R. B. Woodward, N. L. Wendler, F. J. Brutschy. Quininone 1 (англ.) // Journal of the American Chemical Society. — 1945-09. — Vol. 67, iss. 9. — P. 1425–1429. — ISSN 0002-7863. — doi:10.1021/ja01225a001.
- ↑ Takashi Ooi, Hidehito Otsuka, Tomoya Miura, Hayato Ichikawa, Keiji Maruoka. Practical Oppenauer (OPP) Oxidation of Alcohols with a Modified Aluminum Catalyst // Organic Letters. — 2002-08-01. — Т. 4, вып. 16. — С. 2669–2672. — ISSN 1523-7060. — doi:10.1021/ol020094c.
- ↑ Christopher R. Graves, Bi-Shun Zeng, SonBinh T. Nguyen. Efficient and Selective Al-Catalyzed Alcohol Oxidation via Oppenauer Chemistry // Journal of the American Chemical Society. — 2006-10-01. — Т. 128, вып. 39. — С. 12596–12597. — ISSN 0002-7863. — doi:10.1021/ja063842s.
- ↑ Stéphane Caron, Robert W. Dugger, Sally Gut Ruggeri, John A. Ragan, David H. Brown Ripin. Large-Scale Oxidations in the Pharmaceutical Industry // Chemical Reviews. — 2006-07-01. — Т. 106, вып. 7. — С. 2943–2989. — ISSN 0009-2665. — doi:10.1021/cr040679f.
- ↑ Dewick, P. Medicinal Natural Products: A Biosynthetic Approach. — 2nd. — Wiley & Sons, 2001. — P. 243. — ISBN 0471496405.
- ↑ Maria L. S. Almeida, Pavel Kočovský, Jan-E. Bäckvall. Ruthenium-Catalyzed Oppenauer-Type Oxidation of 3β-Hydroxy Steroids. A Highly Efficient Entry into the Steroidal Hormones with 4-En-3-one Functionality // The Journal of Organic Chemistry. — 1996-01-01. — Т. 61, вып. 19. — С. 6587–6590. — ISSN 0022-3263. — doi:10.1021/jo960361q.
- ↑ L. Eignerová, A. Kasal. Intramolecular hydride shift in Oppenauer oxidation of some dihydroxy steroids (англ.) // Collection of Czechoslovak Chemical Communications. — 1976. — Vol. 41, iss. 4. — P. 1056–1065. — ISSN 1212-6950. — doi:10.1135/cccc19761056.
- ↑ Nicholas A. Milas, Frank X. Grossi, Siegfried E. Penner, Samuel Kahn. THE SYNTHESIS OF 1-[CYCLOHEXEN-1'-YL-3-METHYL-1,3,5-OCTATRIEN-7-ONE (C15 KETONE)1] // Journal of the American Chemical Society. — 1948-03-01. — Т. 70, вып. 3. — С. 1292–1292. — ISSN 0002-7863. — doi:10.1021/ja01183a522.
- ↑ Richard Reich, John F. W. Keana. Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor // Synthetic Communications. — 1972-01-01. — Т. 2, вып. 5. — С. 323–325. — ISSN 0039-7911. — doi:10.1080/00397917208061988.
- ↑ Reich, Richard; Keana, John F. W. (1972). Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor. Synthetic Communications. 2 (5): 323–325. doi:10.1080/00397917208061988.