Сульфат бериллия
| Сульфат бериллия | |
|---|---|
 | |
| Общие | |
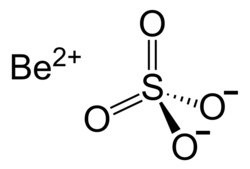
| Хим. формула | BeO4S |
| Физические свойства | |
| Молярная масса |
105.075 г/моль (безводный) 177.136[1] г/моль |
| Плотность |
2.50 г/см³ (безводный) 1.71[1] |
| Термические свойства | |
| Температура | |
| • плавления |
1287 °C (безводный) 110[1] |
| • кипения |
2500 °C (безводный) 580[1] °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 30.5[2] |
| Оптические свойства | |
| Показатель преломления | 1.4374[1] |
| Классификация | |
| Рег. номер CAS | 13510-49-1 |
| PubChem | 26077 |
| Рег. номер EINECS | 236—842-2 |
| SMILES | |
| InChI | |
| RTECS | DS4800000 |
| ChEBI | 53473 |
| ChemSpider | 24291 |
| Безопасность | |
| ЛД50 | 82 мг/кг |
| Токсичность | высокотоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т бери́ллия — химическое соединение с формулой BeSO4. Белое твёрдое кристаллическое вещество. Впервые было обнаружено в 1815 году Якобом Берцелиусом[3].
Применение
Смесь сульфатов бериллия и радия использовалась как источник нейтронов в атомных реакторах. Также очень редко применяются в гомеопатии.
Получение
Сульфат бериллия может быть получен взаимодействием в водном растворе любой соли бериллия с серной кислотой с последующим выпариванием и кристаллизацией продукта реакции. Получаемый гидрат может быть разложен на воду и безводную соль при нагревании до 400 °C[4].
Химические свойства
- Разлагается при высокой температуре до оксида бериллия:
- С кипящей водой реагирует, образуя осадок основной соли:
- В концентрированном аммиачном растворе образует гидроксид бериллия[5]:
Примечания
Литература
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.