Фторид бериллия
| Фторид бериллия | |
|---|---|
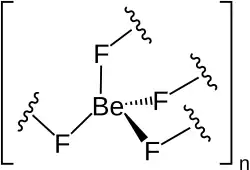 | |
| Общие | |
| Систематическое наименование |
Фторид бериллия |
| Сокращения | Бесцветная гигроскопичная стеклообразная масса |
| Традиционные названия | Фтористый бериллий |
| Хим. формула | BeF2 |
| Физические свойства | |
| Молярная масса | 47,01 г/моль |
| Плотность | 1,986 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 554 °C |
| • кипения | 1169 °C |
| Мол. теплоёмк. | 51,84 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1027 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 84,625 г/100 мл |
| • в этаноле | плохо растворим |
| Структура | |
| Кристаллическая структура | тригональная, типа α-кварца |
| Классификация | |
| Рег. номер CAS | 7787-49-7 |
| PubChem | 24589 и 5357692 |
| Рег. номер EINECS | 232-118-5 |
| SMILES | |
| InChI | |
| RTECS | DS2800000 |
| ChEBI | 49499 |
| ChemSpider | 22992 |
| Безопасность | |
| Токсичность | Ядовит |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фтори́д бери́ллия — бинарное неорганическое химическое соединение бериллия и фтора, химической формулой BeF2, бериллиевая соль фтористоводородной кислоты. Токсичен и канцерогенен, как и все соединения бериллия. Попадание пыли, содержащей галогениды, оксид и другие соединения бериллия, в лёгкие вызывает бериллиоз.
Бесцветные кристаллы или стеклообразная масса. Хорошо растворяется в воде при комнатной температуре. Гидролизуется в горячей воде. Плохо растворяется в этаноле. Образует кристаллогидраты.
Получение
Синтезом из элементов:
- .
Действием газообразного фтористого водорода на оксид, гидроксид или карбонат бериллия:
- .
Действием фтора на оксид бериллия:
- .
В промышленности фторид бериллия получают из загрязнённого гидроксида бериллия, получаемого при переработке бериллиевых руд, обработкой его гидрофторидом аммония с получением тетрафторбериллата аммония:
- .
Ион тетрафторида бериллия устойчив и полученный раствор тетрафторбериллата аммония очищают осаждением из него различных примесей в виде гидрооксидов металлов, который затем разлагают нагреванием:
- .
Физические свойства
Фторид бериллия образует бесцветные гигроскопические кристаллы гексагональной сингонии, решетка типа α-кварца с параметрами a = 0,4750 нм, c = 0,5186 нм, Z = 3.
Также известна тетрагональная модификация с параметрами ячейки a = 0,660 нм, c = 0,674 нм, Z = 8.
Расплав фторида бериллия представляет собой вязкую жидкость с низкой электропроводностью[1]. При затвердевании расплава образует стеклообразную массу[1].
Химические свойства
Водные растворы имеют кислую реакцию вследствие гидролиза по катиону:
- .
Безводный фторид бериллия получают нагреванием кристаллогидрата в токе фтористого водорода:
- .
При нагревании кристаллогидрата на воздухе образуется оксифторид бериллия:
- .
Разлагается в водных растворах при кипячении:
- .
Разлагается сильными концентрированными кислотами, например, в серной кислоте с образованием сульфата бериллия и фтороводорода:
- .
Со щелочами реагирует по-разному в зависимости от концентрации с образованием гидроксида бериллия или бериллата щелочного металла, например, с гидроксидом натрия:
- .
Со фторидами щелочных металлов и аммония образует комплексные соединения — тетрафторбериллаты, из которых тетрафторбериллат натрия малорастворим в воде:
- .
В промышленности металлотермическим восстановлением металлическим магнием в графитовом тигле получают металлический бериллий:
- .
Применение
- В производстве металлического бериллия.
- Компонент специальных стёкол.
- Относительно легкоплавкая (температура плавления 360—459 °C) смесь со фторидом лития используется в качестве теплоносителя и растворителя тетрафторида урана в ядерных реакторов на расплавленных солях[1].
- В биохимии, в основном в кристаллографии белков, как заменитель фосфатов. АДФ и фторид бериллия имеют сродство к сайтами АТФ и свойство ингибировать действие белков, что позволяет кристаллизовать белки в связанном состоянии[2][3].
Токсичность
Фторид бериллия как и все соединения бериллия ядовит. Присутствие фтора в соединении ещё более увеличивает токсичность соединения[4].
ЛД50 для мышей составляет приблизительно 100 мг/кг перорально и около 1,8 мг/кг при внутривенном введении.
Примечания
- 1 2 3 Матясова В. Е., Коцарь М. Л., Алекберов З. М. (ОАО «ВНИИХТ», г. Москва). Фторид бериллия — исходное вещество для производства металлического бериллия и компонентов солевой композиции ядерных реакторов. Дата обращения: 20 февраля 2022. Архивировано 20 февраля 2022 года.
- ↑ Reiko Kagawa; Martin G. Montgomery; Kerstin Braig; Andrew G. W. Leslie; John E. Walker (2004). The structure of bovine F1-ATPase inhibited by ADP and beryllium fluoride. The EMBO Journal. 23 (5): 2734–2744. doi:10.1038/sj.emboj.7600293. PMC 514953. PMID 15229653.
- ↑ Bigay J.; Deterre P.; Pfister C.; Chabre M. (1987). Fluoride complexes of aluminium or beryllium act on G-proteins as reversibly bound analogues of the gamma phosphate of GTP. The EMBO Journal. 6 (10): 2907–2913. doi:10.1002/j.1460-2075.1987.tb02594.x. PMC 553725. PMID 2826123.
- ↑ Fluoride in Drinking Water: A Scientific Review of EPA's Standards : [англ.]. — The National Academies Press, 2006. — P. 51–52. — ISBN 978-0-309-10128-8. — doi:10.17226/11571.
