Фторид платины(VI)
| Фторид платины(VI) | |
|---|---|
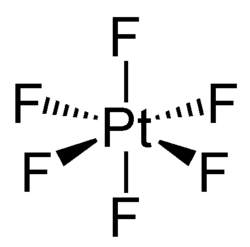 | |
| Общие | |
| Систематическое наименование |
фторид платины(VI) |
| Традиционные названия | гексафторид платины |
| Хим. формула | PtF6 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 309,08 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 61,3 °C |
| • кипения | 69,2 °C |
| Классификация | |
| Рег. номер CAS | 13693-05-5 |
| PubChem | 3014771 |
| Рег. номер EINECS | 237-214-0 |
| SMILES | |
| InChI | |
| ChemSpider | 21106464 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фторид платины(VI) PtF6 (гексафторид платины) — химическое соединение платины и фтора. Платина в этом соединении находится в высшей степени окисления. Представляет собой тёмно-красные летучие кристаллы.
Получение
Химические свойства
Один из сильнейших окислителей. При комнатной температуре способен окислить даже кислород с образованием гексафтороплатината(V) диоксигенила O2PtF6:
Энергично реагирует с водой:
Окисляет ксенон до соединения «XePtF6» (является смесью гексафтороплатинатов ксенона(II)).
При нагревании окисляет ClF5 до ClF6PtF6.
Взаимодействует с трифторидом хлора[1]:
Историческое значение
С помощью гексафторида платины в 1962 году Нилом Бартлеттом было впервые получено соединение благородного газа — ксенона, что разрушило представление о химической инертности «инертных» газов.
Примечания
- ↑ Неорганическая химия / под ред. Ю.Д. Третьякова. М., Академия, 2007. Т. 3, С. 149.
Литература
- «Химическая энциклопедия», т.3, М.: Советская энциклопедия, 1992, стр. 568
