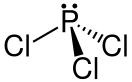
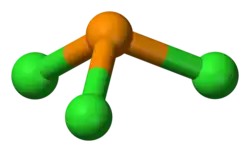
Хлорид фосфора(III)
| Хлорид фосфора(III) | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Хим. формула | Cl3P | ||
| Внешний вид | Прозрачная дымящая жидкость | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 137,33 г/моль | ||
| Плотность | 1,574 г/см³ | ||
| Энергия ионизации | 9,91 эВ[1][2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −93,6 °C | ||
| • кипения | 76,1 °C °C | ||
| Мол. теплоёмк. | 120,9 Дж/(моль·К) | ||
| Давление пара | 13,3 кПа | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | Реагирует | ||
| Оптические свойства | |||
| Показатель преломления | 1,5122 | ||
| Структура | |||
| Дипольный момент | 1,9E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 7719-12-2 | ||
| PubChem | 24387 | ||
| Рег. номер EINECS | 231-749-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | TH3675000 | ||
| ChEBI | 30334 | ||
| Номер ООН | 1809 | ||
| ChemSpider | 22798 | ||
| Безопасность | |||
| ЛД50 | 18 мг/кг (крыса, перорально) | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлори́д фо́сфора(III) PCl3 — химическое соединение фосфора и хлора. Является наиболее важным из трёх известных хлоридов фосфора; ценное химическое сырьё для производства разнообразных фосфорсодержащих органических соединений.
Получение
Мировое производство превышает 300 тысяч тонн в год. Трихлорид фосфора получают в промышленных масштабах путем реакции хлора с белым фосфором. В процессе реакции PCl3 удаляется по мере его образования, чтобы избежать образования пентахлорида фосфора. Реакцию проводят в специальных камерах, часто используя растворитель (обычно это уже полученный трихлорид фосфора). Также можно использовать красный фосфор, но для реакции потребуется большое нагревание ≈ 80°С.[3]
Физические свойства
При нормальных условиях трихлорид фосфора — бесцветная или слегка желтоватая (из-за воздействия хлора), дымящая во влажной среде жидкость с резким неприятным запахом, напомищающим запах соляной кислоты. Обладает слезоточивыми свойствами. Не воспламеняется. Вязкость 0,65 сП при 0 °С; 0,438 сП при 50 °C, что достаточно вязко.
Химические свойства
Фосфор в PCl3 находится в степени окисления +3, а хлор — в степени −1. Многие из свойств соединения обусловлены именно этими обстоятельствами. В присутствии воды — дымит и разлагается на фосфористую кислоту и соляную кислоту.
PCl3 — базовый продукт для других производных фосфора, получаемых из него при окислении до пентахлорида (PCl5), тиофосфорилхлорида (PSCl3) или оксихлорида (POCl3). Например производство хлорокиси фосфора:
Синтез проводят при температуре 50-60°С, постепенно растворяя кислород в хлориде фосфора (lll). Эта реакция также непроизвольно проходит и без нагревания. Для того чтобы предотвратить окисление трихлорида,его хранят в бескислородной среде(или в среде с повышенным содержанием азота).
Если пропустить электрический разряд через смесь пара PCl3 и газообразного водорода, образуется редкий сложный хлорид фосфора с формулой P2Cl4.
Вступает в окислительно-восстановительные реакции:
Последняя реакция обратима и проходит лучше при катализаторе.
Известно большое число сходных реакций замещения, в том числе и с органическими веществами — спиртами и фенолами:
При указанной реакции образуется трифенилфосфин. Это один из способов его промышленного производства.
Спирты реагируют сходным образом:
Наличие неподелённой электронной пары у атомов фосфора обуславливает способность трихлорида проявлять донорные свойства, образуя электронейтральные комплексы, например, [Ni(PCl3)4]. По химической природе трихлорид фосфора является хлорангидридом фосфористой кислоты. Взаимодействие со щелочами образует две соли:
Использование
Основное применение имеет в химической промышленности. Из трихлорида фосфора изготавливается большое количество фосфорсодержащих реагентов. Наиболее важными из них являются: пентахлорид фосфора, хлорокись фосфора, трихлорид тиофосфорила, трифенилфосфин, фосфониевая кислота и др.
Используется для производства пестицидов, пластификаторов, красителей и средств для отделки текстиля. Имеет применение в нефтехимии (как присадок к бензину). Раньше активно использовался в производстве полупроводников.[3]
Безопасность
Этот химикат очень едкий и токсичный; он может вызвать смерть или необратимые ранения. Контакт с жидкостью вызывает сильное раздражение кожи, глаз и слизистых оболочек, а сам материал является раздражителем при оральном и ингаляционном воздействии.[3] ПДК в США составляет 0,5 ppm (OSHA).[5]
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0511.html
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- 1 2 3 PubChem. Phosphorus trichloride (англ.). pubchem.ncbi.nlm.nih.gov. Дата обращения: 7 марта 2025.
- ↑ Clark, Jim (2008). Replacing the OH in alcohols by a halogen Архивная копия от 21 февраля 2009 на Wayback Machine. Retrieved October 9 2008.
- ↑ Phosphorus trichloride - IDLH | NIOSH | CDC (амер. англ.). www.cdc.gov (6 марта 2020). Дата обращения: 7 марта 2025.
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и д.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.