Химия морской среды
| Компонент | Концентрация (mol/kg) |
|---|---|
| H2O | 53.6 |
| Cl- | 0.546 |
| Na+ | 0.469 |
| Mg2+ | 0.0528 |
| SO42- | 0.0282 |
| Ca2+ | 0.0103 |
| K+ | 0.0102 |
| CT | 0.00206 |
| Br- | 0.000844 |
| Общий борBT | 0.000416 |
| Sr2+ | 0.000091 |
| F- | 0.000068 |
Морская химия (также химия океана или химическая океанография) — наука о химическом составе и процессах в Мировом океане, включая взаимодействие между морской водой, атмосферой, морским дном и морскими организмами[2]. Рассматривается круговорот таких элементов, как углерод, азот и фосфор, поведение микроэлементов, газов и питательных веществ в морской среде. Химия морской среды зависит от глобальных биогеохимических циклов, морских течений и влияния деятельности человека (загрязнение и изменение климата) на океанические системы[2]. Учитывается тектоника плит и спрединг морского дна, мутность, течения, осадки, уровень pH, атмосферные составляющие, метаморфическая активность и экология.
Влияние деятельности человека на химию океанов Земли усилилось. Промышленность существенно загрязняет океаны. Более того, повышение уровня углекислого газа в атмосфере Земли привело к закислению океана, что оказывает негативное воздействие на морские экосистемы. Восстановление химии океанов является приоритетной задачей, и усилия по достижению этой цели отслеживаются в рамках Цели устойчивого развития 14 .
Химическая океанография связана с физической океанографией, геологией и геохимией, биологией и биохимией, наукой об атмосфере . Многие из них изучают биогеохимические циклы, причём морской углеродный цикл привлекает значительный интерес из-за его роли в секвестрации углерода и закислении океана[3]. Другие важные темы, представляющие интерес, включают аналитическую химию океанов, загрязнение морской среды и антропогенное изменение климата.
Органические соединения в океанах
Растворённые органические вещества
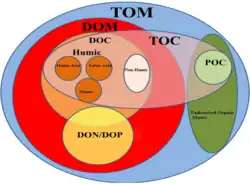
Растворённые органические вещества (англ. DOM) являются важнейшим компонентом углеродного пула океана и включает в себя множество молекул (аминокислоты, сахара, липиды). Составляют около 90 % от общего количества органического углерода в морской среде[4]. Цветное растворённое органическое вещество (англ. CDOM) составляет от 20 до 70 % содержания углерода в океанах, причём его содержание повышено вблизи устьев рек и понижено в открытом океане[5].
Растворённые органические вещества могут быть переработаны и возвращены в пищевую сеть посредством процесса, называемого микробной петлёй[6]. Они также играют важную роль в глобальном регулировании хранения углерода в океане, поскольку некоторые его формы устойчивы к микробному разложению и могут существовать в океане в течение столетий[7]. Морская жизнь является наиболее богатым источником галогенорганических соединений[8].
В состав частиц органического вещества (англ. POM) входят:
- организмы
- фекальные шарики
- детрит.
Частицы органического вещества — основной компонент биологического насоса — процесса, посредством которого углерод переносится с поверхности океана в глубинные воды.
По мере того, как частицы тонут, они разлагается под действием бактерий, выделяя питательные вещества и углекислый газ. Фракция тугоплавкого полиоксиметилена может оседать на дне океана и вносить значительный вклад в секвестрацию углерода в течение очень длительного периода времени[9].
Химическая экология экстремофилов
Такие морские организмы, как экстремофилы, процветают в условиях экстремальных температур, давления и освещенности. Экстремофилы населяют множество уникальных местообитаний в океане, таких как гидротермальные источники, чёрные курильщики, холодные просачивания, гиперсоленые области и карманы с рассолом на морском льду. Некоторые учёные предполагают, что жизнь могла зародиться в гидротермальных источниках океана.
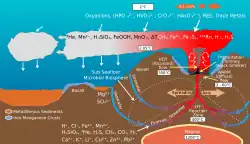
В гидротермальных источниках экстремофилы получают энергию посредством хемоавтотрофии (источник энергии— химические соединения, а не свет, как при фотосинтезе). Гидротермальные источники содержат такие химические вещества, как элементарная сера, H2, H2S, Fe2 + и метан . Хемоавтотрофные организмы, в первую очередь прокариоты, получают энергию из этих химических веществ посредством окислительно-восстановительных реакций, служа впоследствии источниками пищи для более высоких трофических уровней.
В экосистемах гидротермальных источников присутствует несколько различных видов метаболизма. Многие морские микроорганизмы, включая Thiomicrospira, Halothiobacillus и Beggiatoa, способны окислять соединения серы, включая элементарную серу и часто токсичное соединение H2S (цикл серы). Сероводород в гидротермальных источниках образуется при взаимодействии, при высоких температурах, морской воды и горных пород. В более холодных водах, окружающих жерла, окисление серы может происходить с использованием кислорода в качестве акцептора электронов; ближе к жерлам с использованием нитратов. Некоторые виды Thiomicrospira могут использовать тиосульфат в качестве донора электронов, образуя элементарную серу. Такие морские микроорганизмы, как Mariprofundus ferrooxydans, способны окислять железо. Окисление железа может быть кислородным (в богатых кислородом частях океана) или бескислородным, требующим либо акцептора электронов (такого как нитрат), либо световой энергии. При окислении железа Fe(II) используется в качестве донора электронов; наоборот, восстановители железа используют Fe(III) в качестве акцептора электронов. Эти два метаболизма составляют основу железо-окислительно-восстановительного цикла и, возможно, способствовали образованию полосчатого железа .
Некоторые экстремофилы обитают в рассолах морских льдов, где температура очень низкая, а солёность очень высокая(в 3 раза выше, чем в обычной морской воде), что требует приспособления организмов к быстрому изменению солёности при попадании в лёд и при таянии льда. Большинство организмов, обитающих в соляных карманах, являются фотосинтезирующими, поэтому эти микросреды могут стать гиперкислородными, что может быть токсичным для их обитателей. Поэтому эти экстремофилы часто вырабатывают высокие уровни антиоксидантов[10].
Тектоника плит

Спрединг морского дна срединно-океанических хребтов —ионообменная система глобального масштаба[11]. Гидротермальные источники в центрах спрединга привносят в океан различные количества железа, серы, марганца, кремния и других элементов, некоторые из которых повторно используются в океанической коре. Гелий-3, изотоп, сопровождающий вулканизм из мантии, выбрасывается гидротермальными источниками и может быть обнаружен в шлейфах в океане[12].
Скорость спрединга на срединно-океанических хребтах варьируется от 10 до 200 мм/год. Высокие скорости спрединга приводят к усилению реакций базальта с морской водой. Соотношение ионов магний / кальций понижено: ионов магния больше удаляется из морской воды, ионов кальция больше удаляется из породы и высвобождается в морскую воду. Гидротермальная активность на гребне хребта эффективна для удаления магния[13]. Более низкое отношение Mg/Ca способствует осаждению полиморфов карбоната кальция с низким содержанием Mg (кальцитовые моря)[11].
Медленный спрединг на срединно-океанических хребтах имеет противоположный эффект и приводитт к более высокому соотношению Mg/Ca, что благоприятствует осаждению арагонита и полиморфов карбоната кальция с высоким содержанием Mg (арагонитовые моря)[11].
Эксперименты показывают, что большинство современных организмов с высоким содержанием Mg в кальците прошлых кальцитовых морей были бы организмами с низким содержанием Mg в кальците[14]. Соотношение Mg/Ca в скелете зависит от соотношения Mg/Ca в морской воде, в которой организм рос.
Таким образом, минералогия рифообразующих и осадкообразующих организмов регулируется химическими реакциями вдоль срединно-океанического хребта, скорость которых контролируется скоростью расширения морского дна[13][14].
Влияние человека
Загрязнение морской среды
В результате деятельности человека мировой океан загрязняется:
- нефтью и нефтепродуктами, поступающими в него как в результате обычной деятельности по добыче и транспортировке нефти, так и в результате аварий, а также смываемыми с дорог.
- пестицидами, хлорорганическими соединениями (в том числе, диоксинами), фенолами, тяжёлыми металлами (в том числе кадмием и ртутью), радиоактивными веществами
- биогенными элементами (из сточных вод, а также в результате хозяйственной деятельности), что приводит к антропогенной эвтрофикации прибрежных районов
- мусором, в том числе пластиковым (включая микропластик)
- углекислым газом, связанным с деятельностью человека, попадающим из атмосферы (приводит к подкислению морских вод)[15][16][17][18].
Изменение климата
Повышение уровня углекислого газа (из-за сжигания ископаемого топлива) меняет химию океана. Глобальное потепление и изменение солёности[19] —факторы влияния на экологию морской среды[20].
История
.jpg)
Ранние исследования химии морской воды, включая работы Роберта Бойля, обычно касались солёности океана. Современная химическая океанография как отрасль науки зародилась в 1872—1876 годах в ходе экспедиции «Челленджера», тогда был систематически исследован состав морской воды (содержание хлорида, натрия и сульфатов в океанских водах)[21].
В начале XX века в области морской химии произошел значительный прогресс, в частности, благодаря появлению более точных аналитических методов (был создан инструмент сбора проб воды с разных глубин океана — бутылка Кнудсена)[22]. За 1970-е, 1980-е и 1990-е годы, в рамках инициативы Национального научного фонда, известной как «Будущее химии океана в Соединённых Штатах» (FOCUS), была проведена комплексная оценка достижений в области химической океанографии.
После Второй мировой войны исследователи начали использовать изотопный анализ для изучения циркуляции океана и углеродного цикла. Роджер Ревелль и Ганс Зюсс были пионерами в использовании радиоуглеродного датирования для исследования океанических резервуаров углерода и их обмена с атмосферой[23].
Начиная с 1970-х годов учёные смогли измерять содержание следов металлов, органических соединений и изотопных соотношений с беспрецедентной точностью. Исследования морских биогеохимических циклов (циклы углерода, азота и серы) стали основой для понимания глобального изменения климата. Использование технологии дистанционного зондирования и глобальных программ наблюдения за океаном, таких как Международная программа геосферы и биосферы (IGBP), предоставило масштабные данные о химии океана, что позволило учёным отслеживать закисление океана, дезоксигенацию и другие процессы, влияющие на морскую среду.[24]
Инструменты, используемые для анализа
Инструменты химиков-океанографов:
- стандартный набор аналитической химии,
- измерители pH,
- измерители электропроводности,
- флуорометры
- измерители растворённого CO₂.
Большая часть данных собирается посредством измерений на борту судна и с автономных поплавков или буев, но также используется дистанционное зондирование. На океанографическом исследовательском судне проводятся измерения электропроводности, температуры и давления[25], сбор проб производится при помощи бутылок Нансена[26]. Отложения обычно изучаются с помощью ящичного керноотборника или ловушки для осадка, а более старые отложения могут быть извлечены путем научного бурения .

Для обнаружения следовых количеств элементов, изотопов и органических соединений применяется современное аналитическое оборудование[27]:
- масс-спектрометры
- хроматографы.
Автономные подводные аппараты и технологии дистанционного зондирования позволили осуществлять непрерывный крупномасштабный мониторинг химии океана, в частности, отслеживание изменений в закислении океана и циклах питательных веществ[28].
Химия морской среды на других планетах и их спутниках
Предполагается подобие химического состава подповерхностного океана Европы земному[29]. Подповерхностный океан Энцелада выбрасывает в космос водород и углекислый газ[30].
См. также
Примечания
- ↑ DOE. 5 // Handbook of methods for the analysis of the various parameters of the carbon dioxide system in sea water / A.G. Dickson ; C. Goyet. — ORNL/CDIAC-74, 1994. Архивировано {{{2}}}.
- 1 2 Pilson, Michael E. Q. An Introduction to the Chemistry of the Sea. — 2. — Cambridge : Cambridge University Press, 2012. — ISBN 978-0-521-88707-6. — doi:10.1017/cbo9781139047203.
- ↑ Gillis, Justin. Pace of Ocean Acidification Has No Parallel in 300 Million Years, Paper Says (амер. англ.). Green Blog (2 марта 2012). Дата обращения: 28 апреля 2020.
- ↑ Biogeochemistry of marine dissolved organic matter / Hansell ; Carlson. — Amsterdam ; Boston : Academic Press, 2002. — ISBN 978-0-12-323841-2.
- ↑ Coble, Paula G. (2007). Marine Optical Biogeochemistry: The Chemistry of Ocean Color. Chemical Reviews. 107 (2): 402–418. doi:10.1021/cr050350+. PMID 17256912.
- ↑ Azam, F; Fenchel, T; Field, Jg; Gray, Js; Meyer-Reil, La; Thingstad, F (1983). The Ecological Role of Water-Column Microbes in the Sea (PDF). Marine Ecology Progress Series (англ.). 10: 257–263. doi:10.3354/meps010257. ISSN 0171-8630.
- ↑ Hansell, Dennis; Carlson, Craig; Repeta, Daniel; Schlitzer, Reiner (1 декабря 2009). Dissolved Organic Matter in the Ocean: A Controversy Stimulates New Insights. Oceanography. 22 (4): 202–211. doi:10.5670/oceanog.2009.109.
{{cite journal}}:|hdl-access=требует|hdl=(справка) - ↑ Gribble, Gordon W. (2004). Natural Organohalogens: A New Frontier for Medicinal Agents?. Journal of Chemical Education. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021/ed081p1441.
- ↑ Hedges, John I.; Baldock, Jeffrey A.; Gélinas, Yves; Lee, Cindy; Peterson, Michael; Wakeham, Stuart G. (15 февраля 2001). Evidence for non-selective preservation of organic matter in sinking marine particles. Nature (англ.). 409 (6822): 801–804. doi:10.1038/35057247. ISSN 0028-0836.
- ↑ Chemoautotrophy at Deep-Sea Vents: Past, Present, and Future | Oceanography. tos.org. doi:10.5670/oceanog.2012.21. Дата обращения: 8 февраля 2024.
- 1 2 3 Stanley, S.M.; Hardie, L.A. (1999). Hypercalcification: paleontology links plate tectonics and geochemistry to sedimentology. GSA Today. 9 (2): 1–7.
- ↑ Lupton, John (15 июля 1998). Hydrothermal helium plumes in the Pacific Ocean. Journal of Geophysical Research: Oceans. 103 (C8): 15853–15868. Bibcode:1998JGR...10315853L. doi:10.1029/98jc00146. ISSN 0148-0227.
- 1 2 Coggon, R. M.; Teagle, D. A. H.; Smith-Duque, C. E.; Alt, J. C.; Cooper, M. J. (26 февраля 2010). Reconstructing Past Seawater Mg/Ca and Sr/Ca from Mid-Ocean Ridge Flank Calcium Carbonate Veins. Science (англ.). 327 (5969): 1114–1117. Bibcode:2010Sci...327.1114C. doi:10.1126/science.1182252. ISSN 0036-8075. PMID 20133522. S2CID 22739139.
- 1 2 Ries, Justin B. (2004). Effect of ambient Mg/Ca ratio on Mg fractionation in calcareous marine invertebrates: A record of the oceanic Mg/Ca ratio over the Phanerozoic. Geology (англ.). 32 (11): 981. Bibcode:2004Geo....32..981R. doi:10.1130/G20851.1. ISSN 0091-7613.
- ↑ Недостаточно голубая лагуна: что делать, чтобы остановить загрязнение Мирового океана. Forbes.ru (15 июня 2021). Дата обращения: 16 июля 2024.
- ↑ Ковалевич Ольга Геннадьевна. Основные загрязнители Мирового океана // Научные труды Дальрыбвтуза. — 2013. — Т. 28. — С. 7–11. — ISSN 2222-4661.
- ↑ Е. Г. Дурягина НЕФТЕПРОДУКТЫ В МОРСКОЙ СРЕДЕ
- ↑ В. А. Иванов, К. В. Показеев, Е. Е. Совга Загрязнение мирового океана : учебное пособие. Москва : МАКС Пресс, 2006, 163 с., ISBN 5-317-01810-2
- ↑ Ocean salinity: Climate change is also changing the water cycle (англ.). usys.ethz.ch. Дата обращения: 22 мая 2022.
- ↑ Millero, Frank J. (2007). The Marine Inorganic Carbon Cycle. Chemical Reviews. 107 (2): 308–341. doi:10.1021/cr0503557. PMID 17300138.
- ↑ Thomson, C. Wyville. Report on the scientific results of the voyage of H.M.S. Challenger during the years 1873-76 under the command of Captain George S. Nares and the late Captain Frank Tourle Thomson / C. Wyville Thomson, John Murray, George S. Nares … [и др.]. — 1889.
- ↑ Carpenter, James H. (1966). NEW MEASUREMENTS OF OXYGEN SOLUBILITY IN PURE AND NATURAL WATER1. Limnology and Oceanography (англ.). 11 (2): 264–277. doi:10.4319/lo.1966.11.2.0264. ISSN 0024-3590.
- ↑ Revelle, Roger; Suess, Hans E. (1 января 1957). Carbon Dioxide Exchange Between Atmosphere and Ocean and the Question of an Increase of Atmospheric CO2 during the Past Decades. Tellus A: Dynamic Meteorology and Oceanography. 9 (1): 18–27. doi:10.3402/tellusa.v9i1.9075. ISSN 1600-0870.
- ↑ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P.; Linder, S.; Mackenzie, F. T.; Moore III, B.; Pedersen, T.; Rosenthal, Y.; Seitzinger, S. (13 октября 2000). The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System. Science (англ.). 290 (5490): 291–296. doi:10.1126/science.290.5490.291. ISSN 0036-8075.
- ↑ Waveland Press - Introduction to Physical Oceanography, Third Edition, by John A. Knauss, Newell Garfield. www.waveland.com. Дата обращения: 13 октября 2024.
- ↑ Dickson, A.G.; et, al (2007). Guide to best practices for ocean CO2 measurement (Report). [object Object]. doi:10.25607/obp-1342.
- ↑ Aquatic Photosynthesis | Princeton University Press (англ.). press.princeton.edu (11 февраля 2007). Дата обращения: 13 октября 2024.
- ↑ George, Robert A. “Tony” (2006). Advances in AUV remote-sensing technology for imaging deepwater geohazards. The Leading Edge (англ.). 25 (12): 1478–1483. doi:10.1190/1.2405333. ISSN 1070-485X.
- ↑ Greicius, Tony. Europa's Ocean May Have An Earthlike Chemical Balance. NASA (16 мая 2016). Дата обращения: 22 мая 2022.
- ↑ The Chemistry of Enceladus' Plumes: Life or Not?