Хлорфторуглероды
Хлорфторуглероды — органические соединения, состоящие исключительно из атомов хлора (Cl), фтора (F) и углерода (С). Различают низшие хлорфторуглероды (CFC) — низкокипящие органические соединения на основе метанового, этанового и пропанового рядов, а также высшие хлорфторуглероды, являющиеся высокомолекулярными соединениями.
Некоторые хлорфторуглероды могут быть токсичными веществами; в высоких дозах поражают сердечно-сосудистую и нервную системы, вызывают развитие спазмов сосудов и нарушение микроциркуляции крови. Поражают печень, а вследствие развития отравления и почки. Разрушают лёгочные мембраны, особенно при наличии примесей органических растворителей и четырёххлористого углерода — развиваются эмфиземы и рубцевание.
Хлорфторуглероды — запрещается образование смесей с воздухом под давлением, стабильность преувеличена. Распадаются при нагревании в смеси с воздухом с образованием галоген-водородов и фосгенов.
Хлорфторуглероды — флегматизируют горение углеводородов.
Считается[кем?], что толчком в промышленном использовании хлорфторуглеродов послужило предложение Томаса Миджли, американского химика и инженера-механика по их применению в холодильниках вместо используемых ранее токсичных и взрывоопасных хладагентов (аммиака и сернистого газа). Впоследствии низшие хлорфторуглероды (CFC) стали широко использоваться в качестве пропеллентов в аэрозольных баллонах, вспенивающих агентов, взрывобезопасных растворителей.
Высшие хлорфторуглероды нашли широкое применение в качестве манометрических и запорных жидкостей, находящихся в контакте с агрессивными средами (концентрированные кислоты, галогены, жидкий кислород и другие окислители), в качестве жидких негорючих диэлектриков, в качестве смазочных материалов.
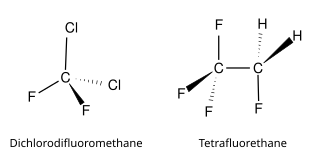
Наиболее распространенным представителем является дифтордихлорметан (Фреон R 12, Фреон-12, Хладон-12, CFC-12, R-12). Многие хлорфторуглероды широко используются в качестве хладагентов, пропеллентов (в аэрозольных системах) и растворителей. Поскольку хлорфторуглероды способствуют истощению озонового слоя в верхних слоях атмосферы, производство таких соединений было прекращено в соответствии с Монреальским протоколом, и они заменяются другими продуктами — такими, как гидрофторуглероды (ГФУ)[1], включая R-410A и R-134a[2][3].
История
До и в течение 1920-х годов холодильники использовали токсичные газы в качестве хладагентов, включая аммиак, диоксид серы и хлорметан. Позже, в 1920-х годах, после серии несчастных случаев со смертельным исходом, связанных с утечкой хлорметана из холодильников, американские корпорации Frigidaire, General Motors и DuPont начали совместную работу по разработке более безопасной, нетоксичной альтернативы. Томас Миджли-младший General Motors приписывают синтез первых хлорфторуглеродов. 31 декабря 1928 года корпорации Frigidaire был выдан первый патент под номером 1 886 339 на формулу для ХФУ. В демонстрации для Американского химического общества Миджли ярко продемонстрировал все эти свойства, вдыхая воздух газа и используя его для задувания в 1930 году.[4][5]
К 1930 году General Motors и Du Pont создали Kinetic Chemical Company для производства фреона, а к 1935 году Frigidaire и её конкуренты продали более 8 миллионов холодильников, использующих R-12. В 1932 году компания Carrier начала использовать R-11 в первом в мире автономном домашнем кондиционере, известном как «атмосферный шкаф». В результате того, что ХФУ в основном нетоксичны, они быстро стали предпочтительным хладагентом в крупных системах кондиционирования воздуха. Кодексы общественного здравоохранения в городах были пересмотрены, чтобы определить хлорфторуглероды в качестве единственных газов, которые могут использоваться в качестве хладагентов в общественных зданиях.[6]
Рост производства ХФУ продолжался в течение следующих десятилетий, что привело к пиковым годовым продажам в размере более 1 миллиарда долларов США, при этом ежегодно производилось более 1 миллиона метрических тонн. Только в 1974 году два химика из Калифорнийского университета, профессор Ф. Шервуд Роуленд и доктор Марио Молина, впервые обнаружили, что использование хлорфторуглеродов вызывает значительное снижение концентрации озона в атмосфере. Это положило начало экологическим усилиям, которые в конечном итоге привели к принятию Монреальского протокола..[7][8]
Коммерческая разработка и использование в тушении пожаров
Во время Второй мировой войны различные хлоралканы были в стандартном использовании в военных самолетах, хотя эти ранние галоны страдали от чрезмерной токсичности. Тем не менее, после войны они постепенно стали более распространёнными и в гражданской авиации. В 1960-х годах фторалканы и бромфторалканы стали доступны и быстро были признаны высокоэффективными материалами для борьбы с пожарами. Большая часть ранних исследований с Halon 1301 проводилась под эгидой Вооружённых сил США, в то время как Halon 1211 первоначально разрабатывался в основном в Великобритании. К концу 1960-х годов они стали стандартом во многих областях применения, где водяные и порошковые огнетушители представляли угрозу повреждения охраняемого имущества, включая компьютерные залы, телекоммуникационные коммутаторы, лаборатории, музеи и художественные коллекции. Начиная с военных кораблей, в 1970-х годах, бромфторалканы также постепенно стали ассоциироваться с быстрым подавлением сильных пожаров в замкнутых пространствах с минимальным риском для персонала.
К началу 1980-х годов бромфторалканы широко использовались на самолётах, кораблях и больших транспортных средствах, а также в компьютерных центрах и галереях. Вместе с тем начинает выражаться обеспокоенность по поводу воздействия хлоралканов и бромалканов на озоновый слой. Венская конвенция об охране озонового слоя не охватывала бромфторалканы под те же ограничения, вместо этого потребление бромфторалканов было заморожено на уровне 1986 года. Это связано с тем, что аварийный сброс систем пожаротушения считался слишком маленьким по объёму, чтобы оказать существенное воздействие, и слишком важным для безопасности человека, чтобы его можно было ограничить.[9]
Регулирование
С конца 1970-х годов использование ХФУ жёстко регулируется из-за их разрушительного воздействия на озоновый слой. После разработки своего детектора захвата электронов Джеймс Лавлок был первым, кто обнаружил широкое присутствие ХФУ в воздухе, обнаружив молярную долю 60 ppt ХФУ-11 над Ирландией. В ходе самофинансируемой исследовательской экспедиции, завершившейся в 1973 году, Лавлок продолжил измерения ХФУ-11 как в Арктике, так и в Антарктике, обнаружив присутствие газа в каждой из 50 собранных проб воздуха и придя к выводу, что ХФУ не опасны для окружающей среды. Тем не менее, эксперимент позволил получить первые полезные данные о присутствии ХФУ в атмосфере. Ущерб, наносимый ХФУ, был обнаружен Шерри Роуленд и Марио Молиной, которые, прослушав лекцию на тему работы Лавлока, приступили к исследованиям, в результате которых в 1974 году была опубликована первая публикация, предполагающая эту связь. Оказывается, что одна из самых привлекательных особенностей ХФУ — их низкая реакционная способность — является ключом к их наиболее разрушительным эффектам. Отсутствие реакционной способности у ХФУ даёт им продолжительность жизни, которая может превышать 100 лет, что даёт им время для диффундации в верхние слои стратосферы..[10] Оказавшись в стратосфере, ультрафиолетовое излучение Солнца достаточно сильное, чтобы вызвать гомолитическое расщепление связи C-Cl. В 1976 году, в соответствии с Законом о контроле над токсичными веществами, EPA запретило коммерческое производство и использование ХФУ и аэрозольных пропеллентов. Позже это решение было заменено поправками 1990 года к Закону о чистом воздухе для решения проблемы истощения стратосферного озона..[11]
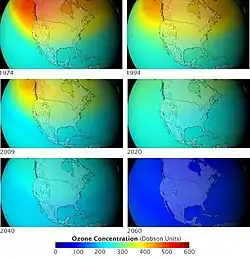
К 1987 году, в ответ на резкое сезонное истощение озонового слоя над Антарктидой, дипломаты в Монреале заключили Монреальский протокол, который призывал к резкому сокращению производства ХФУ. 2 марта 1989 года 12 стран Европейского сообщества договорились о запрете производства всех ХФУ к концу столетия. В 1990 году дипломаты встретились в Лондоне и проголосовали за значительное укрепление Монреальского протокола, призвав к полному отказу от ХФУ к 2000 году. К 2010 году ХФУ должны быть полностью ликвидированы и в развивающихся странах.
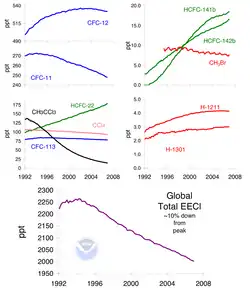
Поскольку страны, присоединившиеся к договору, могут получить только ХФУ, полученные в результате переработки, цены на них значительно выросли. Прекращение производства во всём мире также должно положить конец контрабанде этого материала. Тем не менее, в настоящее время существуют проблемы контрабанды ХФУ, как это было признано Программой Организации Объединённых Наций по окружающей среде (ЮНЕП) в докладе 2006 года под названием «Незаконная торговля озоноразрушающими веществами». По оценкам ЮНЕП, в середине 1990-х годов через чёрный рынок прошло от 16 000 до 38 000 тонн ХФУ. По оценкам доклада, ежегодно в развивающиеся страны контрабандой ввозится от 7 000 до 14 000 тонн ХФУ. Азиатские страны являются странами с наибольшим объемом контрабанды; по состоянию на 2007 год, на долю Китая, Индии и Южной Кореи приходилось около 70% мирового производства ХФУ,[12] Южная Корея позже запретила производство ХФУ в 2010 году..[13] Были также рассмотрены возможные причины продолжающейся контрабанды ХФУ: в докладе отмечается, что многие холодильные системы, которые были разработаны для эксплуатации с использованием запрещённых продуктов ХФУ, имеют длительный срок службы и продолжают работать. Стоимость замены оборудования этих предметов иногда дешевле, чем оснащение их более озонобезопасным прибором. Кроме того, контрабанда ХФУ не считается серьёзной проблемой, поэтому предполагаемые наказания за контрабанду невелики. В 2018 году внимание общественности было привлечено к проблеме, что в неизвестном месте в Восточной Азии примерно с 2012 года в нарушение протокола ежегодно производится примерно 13 000 метрических тонн ХФУ[14] Несмотря на то, что возможный поэтапный отказ от ХФУ в конечном итоге, предпринимаются усилия для устранения этих текущих проблем несоблюдения.
Ко времени принятия Монреальского протокола стало ясно, что преднамеренные и случайные выбросы во время испытаний и технического обслуживания системы составляют значительно большие объёмы, чем аварийные выбросы, и поэтому галоны были включены в договор, хотя и со многими исключениями..[15][16][17]
Нормативный пробел
В то время как производство и потребление ХФУ регулируются Монреальским протоколом, выбросы из существующих банков ХФУ не регулируются соглашением. По оценкам, в 2002 году в существующих продуктах, таких как холодильники, кондиционеры, аэрозольные баллончики и др., содержалось около 5 791 килотонн ХФУ..[18] По прогнозам, примерно треть этих ХФУ будет выброшена в течение следующего десятилетия, если не будут приняты меры, представляющие угрозу как для озонового слоя, так и для климата[19] Часть этих ХФУ может быть безопасно захвачена и уничтожена с помощью высокотемпературного контролируемого сжигания, которое разрушает молекулу ХФУ.[20]
Регулирование и DuPont
В 1978 году США запретили использование ХФУ, таких как фреон, в аэрозольных баллончиках, что положило начало длинной серии регулятивных мер против их использования. В 1979 году истекал срок действия важнейшего производственного патента DuPont на фреон («Процесс фторирования галоуглеводородов», патент США #3258500). Совместно с другими промышленными коллегами DuPont сформировала лоббистскую группу «Альянс за ответственную политику в отношении ХФУ» для борьбы с регулированием озоноразрушающих соединений.[21] В 1986 году DuPont, имея на руках новые патенты, изменила свою прежнюю позицию и публично осудила ХФУ[22] Представители DuPont выступили перед Монреальским протоколом, призывая запретить ХФУ во всём мире, и заявили, что их новые ГХФУ удовлетворят мировой спрос на хладагенты.[22]
Поэтапный отказ от ХФУ
Использование некоторых хлороалканов в качестве растворителей для крупномасштабного применения, например в химчистках, было прекращено, например, директивой IPPC по парниковым газам в 1994 году и директивой летучих органических соединений (ЛОС) ЕС в 1997 году. Разрешённое применение хлорфторалканов возможно только в медицинских целях.
Бромфторалканы были в значительной степени выведены из употребления, и с 1 января 2004 года в некоторых странах, таких как Нидерланды и Бельгия, запрещено владение оборудованием для их использования, на основании Монреальского протокола и руководящих принципов Европейского Союза.
Производство новых запасов прекратилось в большинстве (вероятно, во всех) странах в 1994 году[23][24][25] тем не менее, многие страны по-прежнему требуют, чтобы самолёты оснащались системами пожаротушения галонами, потому что не было найдено безопасной и полностью удовлетворительной альтернативы для этого применения. Есть также несколько других, узкоспециализированных применений. Эти программы перерабатывают галоны через «банки галонов», координируемые Корпорацией по переработке галонов[26] чтобы гарантировать, что выброс в атмосферу происходит только в случае реальной чрезвычайной ситуации, и сохранить оставшиеся запасы.
Промежуточными заменителями ХФУ являются гидрохлорфторуглероды , которые разрушают стратосферный озон, но в гораздо меньшей степени, чем ХФУ[27] В конечном счёте, гидрофторуглероды (ГФУ) заменят ГХФУ. В отличие от ХФУ и ГХФУ, ГФУ имеют озоноразрушающий потенциал (ОРС), равный 0[28]DuPont начала производить гидрофторуглероды в качестве альтернативы фреону в 1980-х годах. К ним относились хладагенты Suva и топливо Dymel[29] Природные хладагенты — это экологически безопасные решения, которые пользуются всё большей поддержкой со стороны крупных компаний и правительств, заинтересованных в сокращении выбросов парниковых газов от систем охлаждения и кондиционирования воздуха.
Поэтапный отказ от ГФУ и ГХФУ
Гидрофторуглероды включены в Киотский протокол и регулируются в соответствии с Кигалийской поправкой к Монреальскому протоколу[30] из-за их очень высокого потенциала глобального потепления и признания вклада галогенуглеродов в изменение климата.[31]
21 сентября 2007 года на саммите в Монреале, организованном ООН, около 200 стран договорились ускорить полный отказ от гидрохлорфторуглеродов к 2020 году. Развивающимся странам было дано время до 2030 года. Многие страны, такие как США и Китай, которые ранее сопротивлялись таким усилиям, согласились с графиком ускоренного поэтапного отказа[32] В 2020 году Индия успешно добилась полного отказа от ГХФУ-141b.[33]
Сообщалось, что в 2021 году уровни ГХФУ в атмосфере начали снижаться из-за их поэтапного отказа в соответствии с Монреальским протоколом.[34]
Надлежащий сбор, контроль и уничтожение ХФУ и ГХФУ

В то время как новое производство этих хладагентов было запрещено, большие объёмы всё ещё существуют в старых системах и, как говорят, представляют непосредственную угрозу для нашей окружающей среды.[35] Предотвращение выброса этих вредных хладагентов было оценено как одно из наиболее эффективных действий, которые мы можем предпринять для смягчения последствий катастрофического изменения климата.[36]
Разработка альтернатив ХФУ
Работа над альтернативами хлорфторуглеродам в хладагентах началась в конце 1970-х годов после того, как были опубликованы первые предупреждения о вреде стратосферного озона.
Гидрохлорфторуглероды (ГХФУ) менее стабильны в нижних слоях атмосферы, что позволяет им разлагаться до того, как они достигнут озонового слоя. Тем не менее, значительная часть ГХФУ действительно разрушается в стратосфере, и они способствуют большему накоплению хлора там, чем первоначально прогнозировалось. Более поздние альтернативы, лишённые хлора, гидрофторуглероды (ГФУ) имеют ещё более короткое время жизни в нижних слоях атмосферы.[27]Одно из этих соединений, ГФУ-134а, использовалось вместо ХФУ-12 в автомобильных кондиционерах. Углеводородные хладагенты (смесь пропана и изобутана) также широко использовались в мобильных системах кондиционирования воздуха в Австралии, США и многих других странах, поскольку они обладали отличными термодинамическими свойствами и особенно хорошо работали при высоких температурах окружающей среды. 1,1-дихлор-1-фторэтан (ГХФУ-141b) пришёл на смену ГФУ-134а из-за его низких значений ОРС и ПГП. Согласно Монреальскому протоколу, до января 2020 года ГХФУ-141b должен быть полностью выведен из эксплуатации и заменен веществами с нулевым уровнем ОРС, такими как циклопентан, ГФО и ГФУ-345а.[37]
Среди природных хладагентов (наряду с аммиаком и углекислым газом) углеводороды оказывают незначительное воздействие на окружающую среду, а также используются во всём мире в бытовых и коммерческих холодильных установках, а также становятся доступными в новых кондиционерах сплит-систем[38] Различные другие растворители и методы заменили использование ХФУ в лабораторном анализе.[39]
В дозированных ингаляторах был разработан заменитель, не влияющий на озон, в виде пропеллента, известного как «гидрофторалкан».[40]
| Применение и замена ХФУ | ||
|---|---|---|
| Приложение | Ранее использованные ХФУ | Замена |
| Охлаждение и кондиционирование воздуха | CFC-12 (CCl2F2); CFC-11(CCl3F); CFC-13(CClF3); HCFC-22 (CHClF2); CFC-113 (Cl2FCCClF2); CFC-114 (CClF2CClF2); CFC-115 (CF3CClF2); | ГФУ-23 (CHF 3); ГФУ-134а (CF3CFH2); ГФУ-507 (азеотропная смесь ГФУ-125 (CF3 CHF2) и HFC-143a (CF3CH3) в соотношении 1:1); HFC 410 (азеотропная смесь HFC-32 (CF2H2) и HFC-125 (CF3CF2H) в соотношении 1:1)) |
| Пропелленты в медицинских аэрозолях | CFC-114 (CClF2CClF2) | HFC-134a (CF3CFH2); HFC-227ea (CF3CHFCF3) |
| Пенообразователи для пенопластов | CFC-11 (CCl3F); CFC 113 (Cl2FCCClF2); HCFC-141b (CCl2FCH3) | HFC-245fa (CF3CH2CHF2); HFC-365 mfc (CF3CH2CF2CH3) |
| Растворители, обезжиривающие средства, чистящие средства | CFC-11 (CCl3F); CFC-113 (CCl2FCClF2) | HCFC-225cb (C3HCl2F5) |
Разработка гидрофторолефинов в качестве альтернативы ХФУ и ГХФУ
Разработка гидрофторолефинов (ГФО) в качестве замены гидрохлорфторуглеродов и гидрофторуглеродов началась после Кигалийской поправки к Монреальскому протоколу в 2016 году, которая призывала к постепенному отказу от хладагентов с высоким потенциалом глобального потепления (ПГП) и замене их другими хладагентами с более низким ПГП, ближе к ПГП углекислого газа[41] ГФО имеют озоноразрушающий потенциал 0,0 по сравнению с 1,0 у основного ХФУ-11, а также низкий ПГП, что делает их экологически более безопасными альтернативами ХФУ, ГХФУ и ГФУ.[42][43]
Гидрофторолефины служат функциональной заменой для применений, где когда-то использовались гидрофторуглероды с высоким ПГП. В апреле 2022 года EPA подписало предварительно опубликованное окончательное правило «Листинг HFO-1234yf» в рамках программы «Политика значительных новых альтернатив» (SNAP) для кондиционирования воздуха в внедорожных транспортных средствах и обслуживания фитингов для небольших баллончиков с хладагентом. Это постановление позволяет HFO-1234yf использоваться в тех областях, где когда-то использовались озоноразрушающие ХФУ, такие как R-12, и ГФУ с высоким ПГП, такие как R-134a[44] Поэтапный отказ от ХФУ и ГФУ в автомобильной промышленности в конечном итоге сократит выбросы этих газов в атмосферу и, в свою очередь, внесёт положительный вклад в смягчение последствий изменения климата.[45][46]
Низшие хлорфторуглероды
| Хлорфторуглерод (CFC) | Химическая формула | Техническое обозначение
по ISO № 817-74 | Температура кипения,
°C |
|---|---|---|---|
| Трифторхлорметан | CF3Cl | R-13 | |
| Дифтордихлорметан | CF2Cl2 | R-12 | |
| Фтортрихлорметан | CFCl3 | R-11 | 23,65 |
| Пентафторхлорэтан | CF3CF2Cl | R-115 | |
| 1,1,2,2-Тетрафтордихлорэтан | CF2ClCF2Cl | R-114 | 3,5 |
| 1,1,1-Трифтортрихлорэтан | CF3CCl3 | R-113a | 45,9 |
| 1,1,2-Трифтортрихлорэтан | CF2ClCFCl2 | R-113 | 47,5 |
| 1,2-Дифтортетрахлорэтан | CFCl2CFCl2 | R-112 | 92,8 |
| 1,2-Дихлоргексафторпропан | CF3CFClCF2Cl | R-216 | 35,7 |
Высшие хлорфторуглероды
| Наименование | Химическая формула X(CF2CFCl)nX, X=F или Cl; n | Средняя относительная молекулярная масса |
|---|---|---|
| жидкость 11ф | 1-4 | 339 |
| жидкость 11фД | 1-4 | 364 |
| жидкость 12ф | 3-7 | 383 |
| жидкость 13ф | 3-7 | 518 |
| жидкость 13фм | 4-8 | 625 |
| масло 4лф | 5-10 | 715 |
| масло 4ф смазка 3ф | 5-10 | 985 |
| Масло 4ф с добавкой 3-5% политрифторхлорэтилена в качестве загустителя | ||
Методы получения
Основным методом получения хлорфторуглеродов является реакция обмена атомов хлора в исходном соединении на фтор действием фтористого водорода в присутствии хлорида сурьмы (V) — реакция Свартса[48][49]:
Гексахлорэтан может быть заменён перхлорэтиленом и хлором[50]:
Хлорфторуглероды возможно получить фторированием перхлоролефинов[51]:
И хлорированием перфторолефинов или фторуглеводородов[47]:
Высшие хлорфторуглероды получают теломеризацией трихлорфторэтилена или деструкцией политрифторхлорэтилена (фторопласта 3) при 400—600 °C с последующим фторированием продуктов деструкции фторидом хлора (III), фторидом кобальта (III) или фторидом сурьмы (V) для стабилизации неустойчивых группировок в молекуле[47].
Химические свойства хлорфторуглеродов
Гидрирование хлорфторуглеродов идёт при высокой температуре с образованием фторуглеводородов[47]:
При повышенной температуре на катализаторе имеет место диспропорционирование хлорфторуглеродов[47]:
В присутствии катализатора — хлорида алюминия хлорфторуглероды алкилируют галогенолефины[47]:
Хлорфторуглероды этанового и пропанового ряда подвергаются дегалогенированию цинком в среде полярного растворителя:
По этой реакции организованно промышленное производство трифторхлорэтилена[47].
Воздействие на окружающую среду
Практически бесконтрольное использование низших хлорфторуглеродов в качестве пропеллентов аэрозольных упаковок, вспенивателей, растворителей и хладагентов привело к накоплению хлорфторуглеродов в атмосфере. С помощью электронного детектора Лавлока обнаружено присутствие хлорфторуглеродов в верхних слоях атмосферы.
Шервуд Роуланд предсказал, что хлорфторуглероды, произведённые человеком, под действием солнечной радиации разлагаются в атмосфере, образуя хлор и моноокись хлора, которые способны эффективно разрушать молекулы озона
- CFCl3 + hν → CFCl2 + Cl,
- Cl + O3 → ClO + O2,
- ClO + O → Cl + O2.
Марио Молина и Пауль Крутцен показали истощающий эффект галогеналканов на озоновый слой стратосферы, являющийся природным защитным экраном Земли от губительного жёсткого ультрафиолетового излучения Солнца.
Венской конвенцией 1985 г. и Монреальским протоколом 1987 г. по защите озонового слоя были запрещены производства низших хлорфторуглеродов.
В 1995 году Паулю Джозефу Крутцену, Шервурду Роуланду и Марио Молине присуждена Нобелевская премия по химии с формулировкой «За работу в атмосферной химии, особенно в части процессов образования и разрушения озонового слоя».
Влияние на глобальное потепление
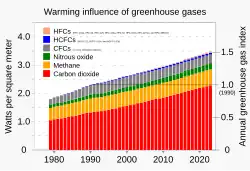
Атмосферное воздействие ХФУ не ограничивается их ролью в качестве озоноразрушающих химических веществ. Инфракрасные полосы поглощения предотвращают выход тепла на этой длине волны из атмосферы Земли. ХФУ имеют самые сильные полосы поглощения от связей C-F и C-Cl в спектральной области 7,8–15,3 мкм[54]называемой «атмосферным окном» из-за относительной прозрачности атмосферы в этой области.[55]
Прочность полос поглощения ХФУ и уникальная восприимчивость атмосферы на длинах волн, где ХФУ (на самом деле все ковалентные соединения фтора) поглощают излучение[56] и создаёт «супер» парниковый эффект от ХФУ и других нереактивных фторсодержащих газов, таких как перфторуглероды, ГФУ, ГХФУ, бромфторуглероды, SF6 и NF3..[57]Это поглощение «атмосферного окна» усиливается из-за низкой концентрации каждого отдельного ХФУ. Поскольку углекислый газ близок к насыщению с высокими концентрациями и небольшим количеством инфракрасных полос поглощения, радиационный баланс и, следовательно, парниковый эффект имеют низкую чувствительность к изменениям концентрации СО2[58] Повышение температуры примерно логарифмическое.[59] И наоборот, низкая концентрация ХФУ позволяет их эффектам линейно увеличиваться с массой,[57] так что хлорфторуглероды являются парниковыми газами с гораздо более высоким потенциалом усиления парникового эффекта, чем CO2.
Группы активно утилизируют устаревшие ХФУ, чтобы снизить их воздействие на атмосферу.[60]
По данным NASA в 2018 году, дыра в озоновом слое начала восстанавливаться в результате запретов на ХФУ.[61] Тем не менее, исследование, опубликованное в 2019 году, сообщает о тревожном росте ХФУ, что указывает на нерегулируемое использование в Китае[62]
См. также
Примечания
- ↑ "Climate Change." The White House. 6 August 2014.
- ↑ Mironov, O. G. Hydrocarbon pollution of the sea and its influence on marine organisms (англ.) // Helgoländer Wissenschaftliche Meeresuntersuchungen : journal. — 1968. — Vol. 17, no. 1—4. — P. 335—339. — doi:10.1007/BF01611234. — .
- ↑ Ozone layer treaty could tackle super polluting HFCs Архивировано 19 августа 2014 года.. rtcc.org. 15 July 2014
- ↑ Carlisle, Rodney. Scientific American inventions and discoveries : all the milestones in ingenuity—from the discovery of fire to the invention of the microwave oven. — John Wiley & Sons, 2004. — P. 351. — ISBN 0-471-24410-4.
- ↑ McNeill, J.R. Something New Under the Sun: An Environmental History of the Twentieth-Century World (The Global Century Series). — W. W. Norton, 2001. — P. 421. — ISBN 978-0-393-32183-8. (as reviewed in Shmelev, Stanislav (December 2002). Something New Under the Sun: An Environmental History of the Twentieth-Century World, by J. R. McNeill (2001), New York: Norton. Reviewed by Michael Bess. Journal of Political Ecology. 9 (1). doi:10.2458/v9i1.21636.
- ↑ NOAA Global Monitoring Laboratory - Halocarbons and other Atmospheric Trace Species (амер. англ.). gml.noaa.gov. Дата обращения: 12 декабря 2023.
- ↑ Chlorofluorocarbons and Ozone Depletion (англ.). American Chemical Society. Дата обращения: 12 декабря 2023.
- ↑ Back from the brink: how the world rapidly sealed a deal to save the ozone layer (брит. англ.). rapidtransition.org. Дата обращения: 12 декабря 2023.
- ↑ Vienna Convention for the Protection of the Ozone Layer. legal.un.org. Дата обращения: 12 декабря 2023.
- ↑ Lee, Bing-Sun; Chiou, Chung-Biau (October 2008). The Relationship of Meteorological and Anthropogenic Factors to Time Series Measurements of CFC-11, CFC-12, and CH3CCl3 Concentrations in the Urban Atmosphere. Atmospheric Environment. 42 (33): 7707. Bibcode:2008AtmEn..42.7706L. doi:10.1016/j.atmosenv.2008.05.042.
- ↑ Auer, Charles; Kover, Frank; Aidala, James; Greenwood, Marks (2016-03-01). Toxic Substances: A Half Century of Progress (PDF) (Report). EPA Alumni Association.
- ↑ Illegal Trade in Ozone Depleting Substances. — United Nations Environmental Programme, 2007. — ISBN 978-92-807-2815-6.
- ↑ S. Korea to ban import, production of freon, halon gases in 2010. Yonhap. 2009-12-23.
- ↑ Ozone hole-forming chemicals are increasing and scientists aren't sure why. The Independent. Дата обращения: 25 февраля 2025.
- ↑ Halon essential use exemptions. DCCEEW (23 февраля 2023). Дата обращения: 17 мая 2024.
- ↑ | Ozone Secretariat. ozone.unep.org. Дата обращения: 12 декабря 2023.
- ↑ Phase out of Halons : Firesafe.org.uk. www.firesafe.org.uk. Дата обращения: 12 декабря 2023.
- ↑ Campbell, Nick et al. "HFCs and PFCs: Current and Future Supply, Demand and Emissions, plus Emissions of CFCs, HCFCs and Halons", Ch. 11 in IPCC/TEAP Special Report: Safeguarding the Ozone Layer and the Global Climate System
- ↑ Chlorofluorocarbons: An Overlooked Climate Threat, EESI Congressional Briefing. Архивировано 4 декабря 2009 года.. Eesi.org. Retrieved on 24 September 2011.
- ↑ The cool way to destroy CFCs (амер. англ.). New Scientist. Дата обращения: 12 декабря 2023.
- ↑ DeSombre, Elizabeth R. Domestic Sources of International Environmental Policy: Industry, Environmentalists, and U.S. Power. — MIT Press, 2000. — P. 93. — ISBN 978-0-262-04179-9.
- 1 2 Smith, Brigitte (1998). Ethics of Du Pont's CFC Strategy 1975–1995. Journal of Business Ethics. 18 (1): 103–114. doi:10.1023/A:1005789810145.
- ↑ Phaseout of Class I Ozone-Depleting Substances (22 июля 2015).
- ↑ Ozone depleting substances (брит. англ.). Ministry for the Environment (1 апреля 2021). Дата обращения: 12 декабря 2023.
- ↑ Management of Environmental Protection in Defence. service.gov.uk. Дата обращения: 17 мая 2024.
- ↑ Welcome to the Halon Corporation. Архивировано 19 сентября 2009 года.. Halon.org. Retrieved on 24 September 2011.
- 1 2 Prinn, R. G.; Weiss, R. F.; Fraser, P. J.; Simmonds, P. G.; Cunnold, D. M.; Alyea, F. N.; O'Doherty, S.; Salameh, P.; Miller, B. R.; Huang, J.; Wang, R. H. J.; Hartley, D. E.; Harth, C.; Steele, L. P.; Sturrock, G.; Midgley, P. M.; McCulloch, A. (2000-07-27). A history of chemically and radiatively important gases in air deduced from ALE/GAGE/AGAGE. Journal of Geophysical Research: Atmospheres. 105 (D14): 17751–17792. Bibcode:2000JGR...10517751P. doi:10.1029/2000JD900141.
- ↑ "Ozone Layer Depletion", U.S. Environmental Protection Agency. Архивировано 19 сентября 2008 года. accessed 25 June 2008
- ↑ Freon : 1930. In Depth. Архивировано 19 марта 2011 года.. dupont.com (30 January 2009). Retrieved on 2011-09-24.
- ↑ Broder, John M. (2010-11-09). A Novel Tactic in Climate Fight Gains Some Traction. The New York Times. p. A9. Архивировано 2013-05-20. Дата обращения: 2013-02-05.
{{cite news}}:|archive-date=/|archive-url=несоответствие временной метки; предлагается 20 мая 2013 (справка) - ↑ Velders, G. J. M.; Andersen, S. O.; Daniel, J. S.; Fahey, D. W.; McFarland, M. (2007). The importance of the Montreal Protocol in protecting climate. Proceedings of the National Academy of Sciences. 104 (12): 4814–9. Bibcode:2007PNAS..104.4814V. doi:10.1073/pnas.0610328104. PMC 1817831. PMID 17360370.
- ↑ HCFC Phaseout Schedule. Архивировано 16 июля 2009 года.. Epa.gov (28 June 2006). Retrieved on 2011-09-24.
- ↑ India achieves complete phase out of one the most potent ozone depleting chemical. pib.gov.in. Дата обращения: 2 июня 2022.
- ↑ Western, Luke M.; Daniel, John S.; Vollmer, Martin K.; Clingan, Scott; Crotwell, Molly; Fraser, Paul J.; Ganesan, Anita L.; Hall, Brad; Harth, Christina M.; Krummel, Paul B.; Mühle, Jens; O’Doherty, Simon; Salameh, Peter K.; Stanley, Kieran M.; Reimann, Stefan; Vimont, Isaac; Young, Dickon; Rigby, Matt; Weiss, Ray F.; Prinn, Ronald G.; Montzka, Stephen A. (2024-06-11). A decrease in radiative forcing and equivalent effective chlorine from hydrochlorofluorocarbons. Nature Climate Change. 14 (8): 805–807. doi:10.1038/s41558-024-02038-7.
- ↑ Emissions of several ozone-depleting chemicals are larger than expected (англ.). MIT News | Massachusetts Institute of Technology (17 марта 2020). Дата обращения: 18 октября 2022.
- ↑ Refrigerant Management @ProjectDrawdown #ClimateSolutions (англ.). Project Drawdown (6 февраля 2020). Дата обращения: 18 октября 2022.
- ↑ acp.copernicus.org article (PDF)
- ↑ "Greenpeace, Cool Technologies". Архивировано 6 июля 2008 года.. (PDF). Retrieved on 24 September 2011.
- ↑ Use of Ozone Depleting Substances in Laboratories. TemaNord 516/2003 Архивировано 27 февраля 2008 года.. Norden.org (1 January 2003). Retrieved on 2011-09-24.
- ↑ Boccuzzi, S. J; Wogen, J; Roehm, J. B (2000). Use of hydrofluoroalkane propellant delivery system for inhaled albuterol in patients receiving asthma medications. Clinical Therapeutics. 22 (2): 237–47. doi:10.1016/S0149-2918(00)88482-9. PMID 10743983.
- ↑ Rusch, George M. (2018). The development of environmentally acceptable fluorocarbons. Critical Reviews in Toxicology. 48 (8): 615–665. doi:10.1080/10408444.2018.1504276. PMID 30474464. S2CID 53745498.
- ↑ The Environmental Benefits of HFOs (амер. англ.). sustainability.honeywell.com. Дата обращения: 12 декабря 2023.
- ↑ Dey, Anup Kumar. What are HFO Refrigerants? Their Benefits and Applications (амер. англ.). What is Piping (11 июля 2023). Дата обращения: 12 декабря 2023.
- ↑ Association of Equipment Manufacturers. AEM. Дата обращения: 17 мая 2024.
- ↑ Automobile Air Conditioners and Chlorofluorocarbons (CFCs). p2infohouse.org. Дата обращения: 12 декабря 2023.
- ↑ Phasing Down HFCs (англ.). www.nrdc.org (9 августа 2022). Дата обращения: 12 декабря 2023.
- 1 2 3 4 5 6 7 8 Промышленные фторорганические продукты: справ. изд / Б. Н. Максимов, В. Г. Барабанов, И. Л. Серушкин и др. — 2-е изд., пер. и доп.. — СПб.: «Химия», 1996. — 544 с. — ISBN 5-7245-1043-X.
- ↑ Гудлицкий М. Химия органических соединений фтора / под ред. А. П. Сергеева. — пер. с чешского Ю.И.Вайнштейн. — М.: Госхимиздат, 1961. — 372 с.
- ↑ Исикава Н., Кобаяси Е. Фтор. Химия и применение / под ред. А. В. Фокина. — пер. с японского М.В.Поспелова. — М.: Мир, 1982. — 280 с.
- ↑ Н. С. Верещагина., А. Н. Голубев., А. С. Дедов, В. Ю. Захаров. Российский химический журнал. Журнал Российского химического общества им. Д. И. Менделеева. — «Химия», 2000. — Т. XLIV, выпуск 2. — С. 110—114.
- ↑ Орехов В. Т., Рыбаков А. Г., Шаталов В. В. Использование обеднённого гексафторида урана в органическом синтезе. — М.: Энергоатомиздат, 2007. — 112 с. — ISBN 978-5-283-03261-0.
- ↑ The NOAA Annual Greenhouse Gas Index (AGGI). NOAA.gov. National Oceanic and Atmospheric Administration (NOAA) (2024). Архивировано 5 октября 2024 года.
- ↑ Appendix 8.A // Intergovernmental Panel on Climate Change Fifth Assessment Report. — P. 731.
- ↑ Rothman, L.S.; Gordon, I.E.; Barbe, A.; Benner, D.Chris; Bernath, P.F.; Birk, M.; Boudon, V.; Brown, L.R.; Campargue, A.; Champion, J.-P.; Chance, K.; Coudert, L.H.; Dana, V.; Devi, V.M.; Fally, S.; Flaud, J.-M.; Gamache, R.R.; Goldman, A.; Jacquemart, D.; Kleiner, I.; Lacome, N.; Lafferty, W.J.; Mandin, J.-Y.; Massie, S.T.; Mikhailenko, S.N.; Miller, C.E.; Moazzen-Ahmadi, N.; Naumenko, O.V.; Nikitin, A.V.; Orphal, J.; Perevalov, V.I.; Perrin, A.; Predoi-Cross, A.; Rinsland, C.P.; Rotger, M.; Šimečková, M.; Smith, M.A.H.; Sung, K.; Tashkun, S.A.; Tennyson, J.; Toth, R.A.; Vandaele, A.C.; Vander Auwera, J. (June 2009). The HITRAN 2008 molecular spectroscopic database. Journal of Quantitative Spectroscopy and Radiative Transfer. 110 (9–10): 533–572. Bibcode:2009JQSRT.110..533R. doi:10.1016/j.jqsrt.2009.02.013.
- ↑ Ramanathan, V (1975). Greenhouse Effect Due to Chlorofluorocarbons: Climatic Implications. Science. New Series. 190 (4209): 50–52. Bibcode:1975Sci...190...50R. doi:10.1126/science.190.4209.50. JSTOR 1740877. S2CID 33736550.
- ↑ Bera, Partha P.; Francisco, Joseph S.; Lee, Timothy J. (2009-11-12). Identifying the Molecular Origin of Global Warming. The Journal of Physical Chemistry A. 113 (45): 12694–12699. Bibcode:2009JPCA..11312694B. doi:10.1021/jp905097g. hdl:2060/20110023746. PMID 19694447.
- 1 2 Ramanathan, V; Y. Feng (2009). Air pollution, greenhouse gases and climate change: Global and regional perspectives. Atmospheric Environment. 43 (1): 37–50. Bibcode:2009AtmEn..43...37R. doi:10.1016/j.atmosenv.2008.09.063.
- ↑ Harnung, Sven E. Chemistry and the Environment / Sven E. Harnung, Matthew S. Johnson. — Cambridge University Press, 2012. — P. 365. — ISBN 978-1-107-02155-6.
- ↑ Roehl, C. M.; Boglu, D.; Brühl, C.; Moortgat, G. K. (April 1995). Infrared band intensities and global warming potentials of , , , , , and. Geophysical Research Letters. 22 (7): 815–818. doi:10.1029/95GL00488.
- ↑ One overlooked way to fight climate change? Dispose of old CFCs. Environment (29 апреля 2019). Дата обращения: 30 апреля 2019. Архивировано из оригинала 29 апреля 2019 года.
- ↑ Samson Reiny. NASA Study: First Direct Proof of Ozone Hole Recovery Due to Chemicals Ban. NASA (4 января 2018). Дата обращения: 2 октября 2019. Архивировано 24 сентября 2020 года.
- ↑ Scientists discover the source of new CFC emissions. ScienceDaily (Press release). University of Bristol. 2019-05-22.