Биологический насос
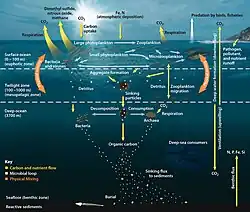
Биологический насос (или океанический углеродный биологический насос или морской биологический углеродный насос) — это биологически обусловленное поглощение углерода из атмосферы и сточных вод с суши во внутренние районы океана и в отложения морского дна. Биологический насос — это биологический компонент «морского углеродного насоса», который содержит как физический, так и биологический компонент. Это часть более широкого круговорота углерода в океане. Органическое вещество образуется фитопланктоном во время фотосинтеза (мягкотканевый насос), также происходит круговорот карбоната кальция (CaCO 3), образуемого в раковинах некоторыми организмами, такими как планктон и моллюски (карбонатный насос)[1].
Расчёты размера биологического углеродного насоса основаны на соотношении между седиментацией (экспорт углерода на дно океана) и реминерализацией (выбросом углерода в атмосферу).
Насос играет важную роль в морской жизни, ежегодно перекачивает в недра океана около 10,2 гигатонн углерода, а в среднем за 127 лет — 1300 гигатонн углерода[2]. Это исключает контакт углерода с атмосферой на несколько тысяч лет и более. Без биологического насоса уровень углекислого газа в атмосфере увеличился бы примерно на 400 ppm по сравнению с сегодняшним днем.
Обзор
Элемент углерод играет центральную роль в климате и жизни на Земле. Углеродный цикл Земли включает в себя перемещение углерода между геосферой, криосферой, атмосферой, биосферой и гидросферой и тесно связан с круговоротами других элементов и соединений. Биологические, физические и гравитационные процессы закачивают органический углерод в глубокие воды моря.
Океан играет основополагающую роль в углеродном цикле Земли, помогая регулировать концентрацию углекислого газа (CO2) в атмосфере. Биологический насос представляет собой набор процессов, которые переносят органический углерод с поверхности в глубины океана и лежит в основе круговорота углерода в океане. Биологический насос — процессы фиксации неорганического углерода в органическом веществе во время фотосинтеза, его трансформация в процессах пищевой цепи (трофодинамика), физическое перемешивание, транспорт и гравитационное осаждение на дно океана.
Биологический насос зависит от доли первичного органического вещества, которое выживает в эвфотической зоне и попадает из поверхностных вод в глубь океана, где оно минерализуется до неорганического углерода. Таким образом углерод переносится против градиента растворённого неорганического углерода(англ. DIC) с поверхности в глубины океана.
Процессы переноса углерода:
- физическое смешивание и перенос растворённого и дисперсного органического углерода (англ. POC)
- вертикальные миграции организмов (зоопланктона, рыб)
- гравитационное осаждение дисперсного органического углерода (англ. POC)[3][4]:526.
Можно выделить три отдельные фазы биологического насоса:
- связывание углерода планктонными фототрофами в эвфотической (освещенной солнцем) поверхностной области океана. Фитопланктон использует углекислый газ (CO2) , азот (N), фосфор (P) и другие микроэлементы (барий, железо, цинк и т. д.) в процессе фотосинтеза для производства углеводов, липидов и белков. Некоторые планктонные организмы (например, кокколитофориды и фораминиферы) объединяют кальций (Ca) и растворённые карбонаты (угольную кислоту и бикарбонат), образуя защитное покрытие из карбоната кальция (CaCO 3)[5]
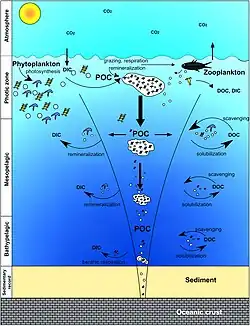
- попадание углерода в мягкие или твёрдые ткани организмов и его переработка в цикле питательных веществ эвфотической зоны, либо, после смерти организмов, попадание на дно океана. Тонущие частицы, образуя агрегаты, увеличивающие скорость погружения, не разлагаются в толще воды и достигают морского дна[5]
- связанный углерод разлагается бактериями либо по пути вниз, либо уже на морском дне, затем реминерализуется для повторного использования в первичном производстве. Другая часть углерода изолируется в осадке на миллионы лет, снижая уровень углекислого газа в атмосфере[5].
Фитопланктон фиксирует неорганические питательные вещества и углекислый газ (англ. DIC) в процессе фотосинтеза и выделяет растворенные органические вещества (англ. DOM). Фитопланктон потребляется растительноядным зоопланктоном.
Более крупный зоопланктон, например, веслоногие рачки, выделяет фекальные гранулы, которые могут быть повторно проглочены и утонуть или агрегироваться. РОВ частично потребляется бактериями (чёрные точки; оставшийся устойчивый РОВ адвектируется и смешивается с глубоководными водами.
DOM и агрегаты, выносимые в глубокие воды, потребляются и выдыхаются, тем самым возвращая органический углерод в огромный глубоководный резервуар DIC.
Около 1 % частиц, покидающих поверхность океана, достигают морского дна и потребляются, вдыхаются или захораниваются в отложениях. Термохалинная циркуляция возвращает глубоководный океанический DIC в атмосферу в тысячелетних масштабах времени.
Первичное производство
Первым шагом в биологическом насосе является синтез органических и неорганических соединений углерода фитопланктоном в самых верхних, освещённых солнцем слоях океана[6]. В процессе фотосинтеза синтезируются органические соединения (углеводы, липиды и белки):
CO2 + H2O + свет → CH2O + O2
Органическое веществ фитопланктона состоит из углерода, азота, фосфора и различных следов металлов . Соотношение углерода к азоту и фосфору варьируется от места к месту[7], но имеет среднее соотношение около 106C:16N:1P (соотношение Редфилда) . Микроэлементы (магний, кадмий, железо, кальций, барий и медь) на порядок менее распространены в органическом материале фитопланктона, но необходимы для определённых метаболических процессов и, следовательно, могут быть ограничивающими питательными веществами в фотосинтезе из-за их меньшей распространенности в толще воды[5].
Первичная продукция океана обеспечивает около половины фиксации углерода на Земле. Ежегодно морской фитопланктон фиксирует около 50-60 Пг углерода, несмотря на то, что на его долю приходится менее 1 % общей фотосинтетической биомассы Земли. ~80 % фиксации происходит в открытом океане,~20 % приходится на апвеллинг океана. Несмотря на то, что при апвеллинге фиксируется в 2-3 раза больше углерода на единицу площади, открытый океан занимает более 90 % площади океана и, поэтому, вносит больший вклад[5].
Формы углерода
Растворенный и твердый углерод
Фитопланктон преобразует неорганические соединения в органические компоненты. Эта автотрофно произведенная биомасса представляет собой основу морской пищевой сети. В результате этих процессов доля растворённого органического углерода (англ. DOC) быстро уменьшается с глубиной[8][9].
Океанические углеродные бассейны
В океане есть четыре основных резервуара углерода:
- растворённый неорганический углерод (РНУ, англ. DIC) является крупнейшим. Он составляет около 38 000 pg С (углерода)[10] и включает растворенный углекислый газ (CO 2), бикарбонат, карбонат и угольную кислоту. Равновесие между угольной кислотой и карбонатом определяет pH (водородный показатель) морской воды. Углекислый газ легко растворяется в воде, и его растворимость обратно пропорциональна температуре. Растворенный CO2 поглощается в процессе фотосинтеза и может снизить парциальное давление CO2 в морской воде, способствуя его выведению из атмосферы. Обратный процесс дыхания, высвобождающий CO2 обратно в воду, может повысить парциальное давление CO2 в морской воде, способствуя его обратному выбросу в атмосферу. Образование карбоната кальция такими организмами, как кокколитофориды, приводит к выделению CO2 в воду[11][12][13]
- растворенный органический углерод (РОУ, англ. DOC) является следующим по величине, его содержание составляет около 662 pg С(углерода)[14]. Углерод можно классифицировать по его реакционной способности как тугоплавкий, полулабильный или лабильный. Лабильный пул составляет около 0,2 pg С, является биодоступным и имеет высокую скорость производства (~ 15−25 pg С в год)[15]. Рефрактерный компонент является самым большим пулом (~642 pg С ± 32;[14] но имеет очень низкую скорость оборота (0,043 pg С в год)[15]. Считается, что время рефрактерного РОУ (англ. DOC) превышает 1000 лет[16][17].
- частицы органического углерода (ЧОУ, англ. POC) составляют около 2,3 pg C[18], и относительно малы по сравнению с DIC и DOC. Несмотря на небольшие размеры, этот пул очень динамичен и имеет самую высокую скорость оборота среди всех пулов органического углерода на планете[19]. За счет первичного производства он производит около 50 pg C в год во всём мире.[20][21][22] Его можно разделить на живой (например, фитопланктон, зоопланктон, бактерии) и неживой (например, детрит) материал. Из них углерод фитопланктона особенно важен из-за его роли в первичной продукции морской среды, а также потому, что он служит источником пищи для всех более крупных организмов в пелагической экосистеме .
- частицы неорганического углерода (ЧНУ, англ. PIC) являются наименьшими из пулов, их содержание составляет около 0,03 pg С.[23] Они присутствуют в виде частиц карбоната кальция (CaCO 3) и влияют на карбонатную систему и pH морской воды. Оценки производства PIC находятся в диапазоне 0,8-1,4 pg C в год, при этом не менее 65 % его растворяется в верхнем слое воды, а остальная часть вносит вклад в глубокие отложения[24]. Кокколитофориды и фораминиферы считаются основными источниками PIC в открытом океане[24][25]. Бассейн PIC имеет особое значение из-за его роли в системе карбонатов океана и в содействии экспорту углерода в глубины океана через карбонатный насос, посредством которого PIC экспортируется из фотической зоны и откладывается в донных отложениях[26].
Карбонат кальция
Частицы неорганического углерода (ЧНУ, англ. PIC) обычно состоят из карбоната кальция (CaCO 3) и играют ключевую роль в круговороте углерода в океане[27]. CaCO 3 используется в качестве защитного покрытия для многих планктонных видов (кокколитофорид, фораминифер), а также для более крупных морских организмов (раковин моллюсков). Карбонат кальция также выделяется с во время осморегуляции у рыб и может образовываться в случаях мальков[28]. Хотя эта форма углерода не извлекается напрямую из атмосферы, она образуется из растворённых форм карбоната, которые находятся в равновесии с CO2 и затем отвечают за удаление этого углерода посредством секвестрации:
CO 2 + H 2 O → H 2 CO 3 → H + + HCO 3 −
Са 2+ + 2HCO 3 − → CaCO 3 + CO 2 + H 2 O
На каждую единицу зафиксированного углерода приходится две единицы щелочности[1][29].
Образование и погружение CaCO 3 создает градиент щелочности от поверхности к глубине, способствующий повышению pH поверхностных вод, изменяя распределение растворённого углерода и повышая парциальное давление растворенного CO 2 в поверхностных водах, что фактически повышает его уровень в атмосфере. Захоронение CaCO 3 в осадках приводит к снижению общей щелочности океана, что приводит к повышению pH и, следовательно, уровня CO 2 в атмосфере, если это не компенсируется новым притоком щелочности в результате выветривания. Углерод, навсегда захороненный на морском дне, становится частью геологической летописи. Карбонат кальция часто образует значительные отложения, которые затем могут быть подняты на сушу в результате тектонических движений, как в случае с Белыми скалами Дувра в Южной Англии. Эти скалы почти полностью состоят из пластин захороненных кокколитофорид.
Океанический углеродный цикл
Три основных процесса (или насоса) морского углеродного цикла переносят атмосферный углекислый газ (CO2) в недра океана и распределяют его по океанам:
- насос растворимости
- насос карбоната
- биологический насос.
Общий активный пул углерода на поверхности Земли за период менее 10 000 лет составляет примерно 40 000 гигатонн углерода (Гт С, гигатонна равна одному миллиарду тонн или весу приблизительно 6 миллионов синих китов), и около 95 % (~38 000 Гт С) хранится в океане, в основном в виде растворённого неорганического углерода[30][31]. Образование растворённого неорганического углерода в морском углеродном цикле — основной регулятор кислотно-щелочного баланса в океанах.
Насос растворимости
Насос растворимости переносит значительные объёмы углерода в форме растворённого неорганического углерода (РНУ, англ. DIC) с поверхности океана в его недра. Он включает в себя только физические и химические процессы и не включает в себя биологические процессы[32].
Насос растворимости состоит из двух процессов в океане:
- Растворимость углекислого газа (находится в сильной обратной зависимости от температуры морской воды, то есть растворимость выше в более холодной воде).
- Термохалинная циркуляция (обусловлена образованием глубоких вод в высоких широтах, где морская вода обычно более холодная и плотная).
Глубинная вода содержит более высокую концентрацию растворённого неорганического углерода, чем можно было бы ожидать, исходя из средних поверхностных концентраций. Следовательно, эти два процесса действуют совместно, перекачивая углерод из атмосферы в недра океана. Одним из последствий этого является то, что когда глубокие воды поднимаются в более тёплые экваториальные широты, они интенсивно выделяют углекислый газ в атмосферу[33].
Карбонатный насос
Карбонатный насос —"твёрдотканевый" компонент биологического насоса[34]. Такие морские организмы, как кокколитофориды, создают твёрдые структуры из карбоната кальция, формы дисперсного неорганического углерода (DIC), путём фиксации бикарбоната[35]:
Са 2+ + 2 HCO 3 − → CaCO 3 + CO 2 + H 2 O
В то время как биологический углеродный насос фиксирует неорганический углерод (CO2) в виде частиц органического углерода в форме C6H12O6 , карбонатный насос фиксирует неорганический бикарбонат и вызывает чистый выброс CO2[35], являясь карбонатным противонасосом.
Насос континентального шельфа
Континентальный шельфовый насос — механизм транспортировки углерода (растворенный или в виде частиц) из мелководья континентальных шельфов вглубь прилегающего глубокого океана[36]. Возникает там, где насос растворимости взаимодействует с более холодной и, следовательно, более плотной водой со дна шельфа, стекающей по континентальному склону в соседний глубокий океан[36]. Мелководность континентального шельфа ограничивает конвекцию охлаждающей воды, поэтому охлаждение вод континентального шельфа может быть сильнее, чем в соседних водах открытого океана. Эти более прохладные воды стимулируют насос растворимости и приводят к увеличению запасов растворённого неорганического углерода . Это дополнительное хранение углерода ещё больше увеличивается за счёт увеличения биологической продуктивности, характерной для полок. Плотные, богатые углеродом шельфовые воды затем опускаются на дно шельфа и попадают в подповерхностный слой открытого океана посредством изопикническогосмешивания[36]. По мере повышения уровня моря, в ответ на глобальное потепление, площадь поверхности шельфовых морей будет увеличиваться, и, как следствие, мощность насоса шельфового моря должна возрасти[37].
Процессы в биологическом насосе
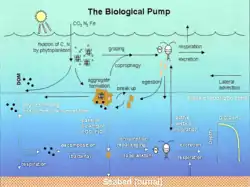
Фитопланктон преобразует CO2 из атмосферы, растворившегося в поверхностных слоях океанов (90 Гт год −1), в твёрдый органический углерод (POC) в процессе первичного производства (~ 50 Гт С год −1).
Веслоногие рачки, криль и другие мелкие травоядные зоопланктонные организмы питаются фитопланктоном, в свою очередь, становясь добычей более высоких трофических уровней. Любой неиспользованный фитопланктон образует агрегаты и вместе с фекальными гранулами зоопланктона быстро тонет и выносится из смешанного слоя (< 12 Гт С год −1 14).
Криль, веслоногие рачки, зоопланктон и микробы потребляют и выдыхают этот РОС в CO2 (растворённый неорганический углерод, DIC), только небольшая часть углерода, произведенного на поверхности, опускается в глубокие слои океана (то есть на глубины > 1000 м). Криль и более мелкий зоопланктон в процессе питания физически дробят частицы на мелкие, медленно или нетонущие частички (из-за неаккуратного питания, копрорексии при фрагментации фекалий)[39], замедляя спуск POC. При этом растворённый органический углерод (РОУ) высвобождается либо непосредственно из клеток, либо косвенно посредством бактериальной солюбилизации . Бактерии затем могут реминерализовать DOC до DIC (CO2, микробное садоводство).
Биологический углеродный насос — один из главных факторов вертикального распределения углерода в океанах и, следовательно, поверхностного парциального давления CO 2 , регулирующего обмен CO 2 между воздухом и морем[40].
Биологический углеродный насос состоит из:
- клеток фитопланктона
- потребителей фитопланктона и бактерий, усваивающих их отходы
Биологический углеродный насос доставляет углерод из атмосферы в глубокие слои моря, где он концентрируется и изолируется на протяжении длительного времени[41].
Фотосинтез фитопланктона снижает парциальное давление CO 2 в верхних слоях океана, что способствует поглощению CO 2 из атмосферы за счет создания более крутого градиента CO 2[42]. Это также приводит к образованию взвешенного органического углерода (ВОУ) в эвфотическом слое эпипелагиали (глубина 0-200 м).
ВОУ перерабатывается микробами, зоопланктоном и их потребителями в:
- фекальные гранулы
- органические агрегаты («морской снег»)
- другие формы.
Переработанный ВОУ затем экспортируются в мезопелагическую (глубина 200—1000 м) и батипелагическую зоны путем погружения и вертикальной миграции зоопланктоном и рыбой.[43] Хотя первичная продукция включает как растворенный, так и твердый органический углерод (DOC и POC соответственно), только POC приводит к эффективному экспорту углерода в глубь океана, тогда как фракция DOC в поверхностных водах в основном перерабатывается бактериями[44]. Однако более биологически устойчивая фракция РОУ, образующаяся в эвфотической зоне (составляющая 15-20 % чистой продуктивности сообщества), не сразу минерализуется микробами и накапливается на поверхности океана в виде биологически полулабильного РОУ[45], который экспортируется в глубины океана, таким образом составляя динамическую часть биологического углеродного насоса[46]. Эффективность производства и экспорта DOC различается в зависимости от океанографических регионов, но наиболее выражена в олиготрофных субтропических океанах[47]. Общая эффективность биологического углеродного насоса в основном контролируется экспортом POC[44].
Морской снег
Глубокий океан получает большую часть питательных веществ из верхних слоёв воды, когда они опускаются вниз в виде морского снега, состоящего из мёртвых или умирающих животных и микробов, фекалий, песка и других неорганических материалов[48]. Скорость погружения одной клетки фитопланктона составляет около одного метра в день. С учётом средней глубины океана, равной около четырёх километров, время достижения дна океана этими клетками велико, более десяти лет. Однако агрегаты морского снега имеют скорость погружения на порядки большую, чем отдельные клетки, поэтому путешествие на глубину завершается за считанные дни[5]:
- фитопланктон фиксирует CO2 в эвфотической зоне, используя солнечную энергию, производит твердый органический углерод (англ. POC)
- образующийся в эвфотической зоне POC перерабатывается микробами, зоопланктоном и их потребителями в органические агрегаты (морской снег), которые затем выносятся в мезопелагическую (глубина 200—1000 м) и батипелагическую зоны путем погружения и вертикальной миграции зоопланктона и рыб. Поток выноса определяется как седиментация из поверхностного слоя (на глубине примерно 100 м), а поток секвестрации — это седиментация из мезопелагиали (на глубине примерно 1000 м)
- часть РОС вдыхается обратно в CO2 в толще океанической воды на глубине гетеротрофными микробами и зоопланктоном, тем самым поддерживая вертикальный градиент концентрации растворённого неорганического углерода(РНУ, англ. DIC)
- глубоководный океанический DIC возвращается в атмосферу в течение тысячелетних периодов времени посредством термохалинной циркуляции. От 1 % до 40 % первичной продукции экспортируется из эвфотической зоны, которая экспоненциально затухает по направлению к основанию мезопелагиаля, и только около 1 % поверхностной продукции достигает морского дна[43][49].
Из 50-60 Пг углерода, фиксируемого ежегодно[5]:
- ~10 % покидает поверхностный смешанный слой океанов
- менее 0,5 % в конечном итоге достигает морского дна.
Большая часть сохраняется в регенерированной продукции в эвфотической зоне, а значительная часть реминерализуется в процессах в средних слоях воды во время погружения частиц. Часть углерода, покидающая поверхностный смешанный слой океана, считается выведенной из контакта с атмосферой на многие столетия[49]. Однако, в Южном океане, большая часть этого углерода может быстро (в течение десятилетий) вернуться в контакт с атмосферой[50].
Расчёты биологического углеродного насоса основаны на соотношении между седиментацией (экспортом углерода) и реминерализацией (выбросом в атмосферу).
Тонущие частицы переносят до 25 % углерода, захваченного фитопланктоном на поверхности океана[51]. Около 20 % этого экспорта (5 % от поверхностных значений) захоронено в морских отложениях [52] в основном из-за их минерального балласта. Погружающиеся органические частицы становятся очагами микробной активности и представляют собой важные места минерализации органического вещества и перераспределения питательных веществ в толще воды[53][54][55].
Биоминерализация
Минералы балластные
Потоки балластных минералов (карбонат кальция, опал и литогенный материал) и потоки органического углерода тесно связаны в батипелагических зонах океана[56]. Значительная часть твердых органических веществ встречается в виде агрегатов морского снега (>0,5мм)[57]. Образование и погружение этих агрегатов запускает биологический углеродный насос. Доля органического вещества, покидающего верхний смешанный слой океана, определяется, помимо прочего, скоростью погружения и скоростью микробной реминерализации этих агрегатов. Гипотетически, экспорт органического углерода определяется наличием балластных минералов в оседающих агрегатах[58][59][60].
Доля минерального балласта органического углерода в виде частиц (POC)[61]:
- 60 % потока в высокоширотной части Северной Атлантики
- 40 % потока в Южном океане.
В глубоком океане также существует сильная корреляция между наличием балластных минералов и потоком POC[62].
Было высказано предположение, что органический углерод лучше сохраняется в тонущих частицах из-за повышенной плотности агрегатов и повышенной скорости опускания при наличии балластных минералов и/или посредством защиты органического вещества из-за количественной ассоциации с балластными минералами[58][59][60].
В 2002 году ~83 % мировых потоков органического углерода (POC) были связаны с карбонатом, более эффективным балластным минералом по сравнению с опалом и терригенным материалом. Более высокая плотность карбоната кальция может быть причиной эффективного балластирования карбонатом кальция. Однако прямое воздействие балластных минералов на скорость погружения и скорость деградации в тонких агрегатах до сих пор неясно[60].
Исследование 2008 года показало, что фекальные гранулы веслоногих рачков, питающихся диатомовыми водорослями или кокколитофоридами, погружаются быстрее по сравнению с гранулами, полученными при питании нанофлагеллятами[63]. Однако удельные скорости дыхания по углероду в гранулах были схожими и не зависели от содержания минералов. Различия в минеральном составе не приводят к дифференциальной защите РОС от микробной деградации, но повышенная скорость погружения может привести к 10-кратному повышению сохранности углерода в гранулах, содержащих биогенные минералы, по сравнению с гранулами без биогенных минералов[63].
Минералы:
- усиливают флокуляцию агрегатов фитопланктона. [64][65]
- могут действовать как катализатор в образовании агрегатов[66]
- могут привести к фрагментации агрегатов на более мелкие и плотные агрегаты[67]. Это может потенциально снизить скорость погружения агрегированного органического материала за счет уменьшения размеров агрегатов и, таким образом, снизить общий экспорт органического вещества. И наоборот, если включение минералов увеличивает плотность агрегата, скорость его погружения в зависимости от размера может также увеличиться, что потенциально может привести к увеличению экспорта углерода. Таким образом, по-прежнему существует необходимость в более точных количественных исследованиях того, как взаимодействие между минералами и органическими агрегатами влияет на деградацию и скорость погружения агрегатов и, следовательно, на секвестрацию углерода в океане.[67]
Реминерализация
Реминерализация — это процесс распада или преобразования органического вещества (молекул, полученных из биологического источника) в его простейшие неорганические формы. Эти преобразования образуют важнейшее звено в экосистемах, поскольку они отвечают за высвобождение энергии, хранящейся в органических молекулах, и переработку материи в системе для повторного использования в качестве питательных веществ другими организмами[4].
Доля реминерализации:
- в Северном море значения отложения углерода составляют ~1 % от первичной продукции[68]
- в открытом океане в среднем это значение <0,5 %.[69].
Большая часть питательных веществ перерабатывается биотой. Гетеротрофные организмы будут использовать материалы, произведенные автотрофными (и хемотрофными) организмами, и посредством дыхания будут реминерализовать соединения из органической формы обратно в неорганическую, делая их снова доступными для первичных производителей.
Показатели реминерализации углерода по глубине:
- от 100–1200 м (330–3900 футов) — высокие
- от 1,200 м (3,9 фута), где скорость реминерализации — низкие (0,1 мкмоль кг −1 год −1)[70].
Верхние поверхностные воды остаются без неорганических питательных веществ[71]. Большая часть реминерализации осуществляется с помощью растворенного органического углерода (англ. РОУ). Исследования показали, что именно более крупные тонувшие частицы переносят вещество на морское дно[72] в то время как взвешенные частицы и растворенные органические вещества в основном потребляются в процессе реминерализации[73]/ Это происходит отчасти из-за того, что организмы обычно должны потреблять питательные вещества в меньших количествах, чем они сами, часто на порядки величины[74]. Поскольку микробное сообщество составляет 90 % морской биомассы[75], то именно частицы, меньшие, чем микробы (порядка 10), захватываются для реминерализации.[76]
Ключевая роль фитопланктона
Половину всего фотосинтеза на Земле осуществляет морской фитопланктон[77]. Углекислый газ — один из основных факторов глобальных изменений и основная проблема XX века[78]. Углекислый газ (CO2), образующийся в результате антропогенной деятельности, такой как вырубка лесов и сжигание ископаемого топлива для производства энергии, быстро растворяется в поверхностном слое океана и снижает pH морской воды, в то время как CO2, остающийся в атмосфере, повышает глобальную температуру и приводит к усилению термической стратификации океана. Если до промышленной революции концентрация CO2 в атмосфере оценивалась примерно в 270 ppm, то в настоящее время она возросла примерно до 400 ppm[79] и, как ожидается, достигнет 800—1000 ppm к концу этого столетия при сценарии выбросов CO 2 «как обычно»[80].
Морские экосистемы поглощают треть антропогенных выбросов CO2 из атмосферы[79][80]. CO 2 из атмосферы переносится в океаны, а затем в осадки вследствие комбинированного эффекта растворимости и биологического насоса[81].
Насос растворимости концентрирует растворённый неорганический углерод (CO 2 плюс ионы бикарбоната и карбоната) в глубоких слоях океана, биологический углеродный насос (ключевой естественный процесс и основной компонент глобального углеродного цикла, регулирующий уровень CO 2 в атмосфере) переносит как органический, так и неорганический углерод, зафиксированный первичными продуцентами (фитопланктоном) в эвфотической зоне, во внутреннюю часть океана и затем в нижележащие отложения[41][81]. Таким образом, биологический насос выводит углерод из контакта с атмосферой на несколько тысяч лет или дольше и поддерживает уровень CO2 в атмосфере на значительно более низком уровне, чем если бы его не было[82]. Отсутствие биологического насоса океана, перекачивающего примерно 11 Гт С в год во внутренние части океана, привело бы к повышению уровня CO2 в атмосфере примерно на 400 частей на миллион[83][84].
Пассов и Карлсон определили седиментацию из поверхностного слоя (на глубине примерно 100 м) как «поток выноса», а из мезопелагиали (на глубине примерно 1000 м) как «поток секвестрации»[49]. Согласно результатам моделирования Бусселера и Бойда, от 1 % до 40 % первичной продукции выносится из эвфотической зоны[85], которая экспоненциально затухает по направлению к основанию мезопелагиаля, и только около 1 % поверхностной продукции достигает морского дна[86]. В Северной Атлантике более 40 % чистой первичной продукции экспортируется из эвфотической зоны по сравнению с всего лишь 10 % в южной части Тихого океана[85], и это зависит от состава фитопланктона, включая размер и состав клеток (см. ниже). Экспортируемый органический углерод реминерализуется, то есть снова выдыхается до СО2 в толще океанической воды на глубине, в основном гетеротрофными микробами и зоопланктоном. Таким образом, биологический углеродный насос поддерживает вертикальный градиент концентрации растворенного неорганического углерода (РНУ, англ. DIC), с более высокими значениями при увеличении глубины океана[87]/ Этот глубоководный DIC возвращается в атмосферу в тысячелетние временные масштабы посредством термохалинной циркуляции.
В 2001 году Хью и другие выразили эффективность биологического насоса как количество углерода, экспортируемого из поверхностного слоя (экспортная продукция), делённое на общее количество, произведенное фотосинтезом (общая продукция). Моделирование, проведённое Бюсселером и Бойдом, показало, что общая эффективность переноса биологического насоса определяется такими факторами, как:
- сезонность[85]
- состав видов фитопланктона
- фрагментация частиц зоопланктоном
- растворение частиц микробами
- агрегация и дезагрегация богатых органикой агрегатов и взаимодействия между агрегатами ВОУ и взвешенными «балластными» минералами[88].
Балластные минералы (силикатные и карбонатные биоминералы, а также пыль) обеспечивают большую часть разницы в плотности, необходимую для погружения частиц[58]. Агрегация частиц увеличивает вертикальный поток за счет преобразования мелких взвешенных частиц в более крупные, быстро тонущие. Агрегация играет важную роль в осаждении фитодетрита из поверхностного слоя цветущего фитопланктона[43].
Как показал Тернер в 2015 году, вертикальный поток тонущих частиц в основном обусловлен комбинацией фекальных гранул, морского снега и прямого осаждения цветущего фитопланктона, обычно состоящего из диатомовых водорослей, кокколитофорид, динофлагеллятов и другого планктона[43]. Морской снег состоит из макроскопических органических агрегатов (размером >500 мкм), они происходят из комков агрегированного фитопланктона (фитодетрита), отброшенных домиков аппендикулярий, фекалий и других разнообразных детритных частиц[43]. Аппендикулярии выделяют слизистые структуры для питания или «домики», чтобы собирать пищевые частицы, а затем отбрасывать и обновлять их до 40 раз в день[89]. Выброшенные домики аппендикулярий встречаются в большом количестве (тысячи на м3 поверхностных вод) и являются очагами микробиологической активности с высокой концентрацией бактерий, инфузорий, жгутиконосцев и фитопланктона. Таким образом, эти выброшенные домики являются одними из важнейших источников агрегатов, непосредственно производимых зоопланктоном[90].
Состав сообщества фитопланктона в эвфотической зоне определяет количество и качество тонущего органического вещества[86].
Основные функциональные группы морского фитопланктона:
- азотфиксаторы (диазотрофные цианобактерии)
- силицификаторы (диатомовые водоросли)
- кальцинаторы (кокколитофориды).
Каждая из этих групп фитопланктона отличается размером и составом клеточных стенок и оболочек[91] Автотрофный пикопланктон (0,2-2 мкм в диаметре), включающий такие таксоны, как цианобактерии (например, Prochlorococcus spp. и Synechococcus spp.) и празинофиты (различные роды эукариот <2 мкм) — вносит гораздо меньший вклад в экспорт углерода из поверхностных слоев из-за их небольшого размера, медленной скорости погружения (<0,5 м/день) и быстрого оборота в микробной петле[91][92].
Более крупные клетки фитопланктона, такие как диатомовые водоросли (2-500 мкм в диаметре) очень эффективно транспортируют углерод на глубину[49]. Они уникальны среди фитопланктона, поскольку им требуется Si в форме кремниевой кислоты (Si(OH)4) для роста и образования их панцирей, которые состоят из биогенного кремния (bSiO2) и действуют как балласт[91][93]. Скорость погружения диатомовых водорослей может составлять от 0,4 до 35 м/день[91][93][94]. Аналогично, кокколитофориды покрыты пластинами карбоната кальция, называемыми «кокколитами», которые играют центральную роль в агрегации и балластировке, обеспечивая скорость погружения около 5 м/день[49][91]. Пикофитопланктон, характеризующий обширные олиготрофные области океана[86] не вносит существенного вклада в поток органического углерода в виде частиц (POC), однако весь фитопланктон, включая клетки пикопланктона, в равной степени способствует экспорту POC[92]. Аальтернативные пути круговорота углерода пикопланктона основаны на агрегации как механизме как прямого погружения (экспорт пикопланктона в виде POC), так и погружения продукции, основанной на пикопланктоне, с участием мезозоопланктона или крупных фильтраторов.
Выпас зоопланктона
Небрежное кормление

Собрано из ловушек морского снега (a–c) и седиментационных ловушек (d–f). Морфологические классы: (a, d) круглые, (b, e) цилиндрические и (c, f) яйцевидные. Масштабная линейка = 0,5 мм
Зоопланктон, наряду с фитопланктоном — «переработчик» углерода и других питательных веществ, которые существенно влияют на морские биогеохимические циклы, включая биологический насос. Это особенно актуально для веслоногих рачков и криля и особенно важно в олиготрофных водах открытого океана. В результате неаккуратного питания, выделения, экскреции и выщелачивания фекальных гранул зоопланктон выделяет растворённое органическое вещество (РОВ, англ. DOM), которое контролирует круговорот РОВ и поддерживает микробный цикл.
Экскреция и неаккуратное питание (физическое разрушение источника пищи) составляют 80 % и 20 % высвобождения РОВ ракообразным зоопланктоном[96]. Выщелачивание фекальных гранул вносит незначительный вклад. У простейших травоядных РОВ выделяется через экскрецию и пищеварение, у желеобразного зоопланктона —посредством выработки слизи. Выщелачивание фекальных гранул может длиться от нескольких часов до нескольких дней после первоначальной экскреции, а его последствия могут варьироваться в зависимости от концентрации и качества пищи[97][98].
Фекальные гранулы
Фекальные гранулы зоопланктона — важное транспортное средство для переноса твёрдых частиц органического углерода (англ. POC) в глубины океана. В эпипелагиале образуется большое количество мелких фекальных гранул. Однако в более глубоких слоях мелкие фекальные шарики встречаются редко, внося лишь незначительный вклад в потоки фекальных гранул в мезо- и батипелагических слоях, особенно по углероду. В исследовании в море Скоша (самый продуктивный регион Южного океана) преобладающие фекальные гранулы в верхнем мезопелагиале имели цилиндрическую и эллиптическую форму, тогда как в батипелагиале преобладали овальные . Поток углерода в более глубокие слои Южного океана в значительной степени регулируется мезо- и батипелагическим зоопланктоном, а это означает, что структура сообщества в этих зонах оказывает большое влияние на эффективность переноса фекальных гранул в глубины океана.
Эффективность поглощения (AE) — это доля пищи, поглощенной планктоном. Она зависит от скорости питания и состава добычи. Низкие нормы кормления обычно приводят к высокой эффективности поглощения и мелким плотным гранулам, тогда как высокие нормы кормления обычно приводят к низкой эффективности и более крупным гранулам с большим содержанием органики.
Другим фактором, способствующим высвобождению РОВ (англ. DOM), является частота дыхания. Физические факторы, такие как доступность кислорода, pH и условия освещенности, могут влиять на общее потребление кислорода и на объём потерь углерода зоопланктоном в виде вдыхаемого CO2 . Относительные размеры зоопланктона и добычи также влияют на количество углерода, выделяемого при неаккуратном питании. Более мелкая добыча поглощается целиком, тогда как более крупная добыча может быть съедена более «небрежно», то есть больше биоматериала высвобождается из-за неэффективного потребления[99][100]. Состав рациона может влиять на высвобождение питательных веществ, так при плотоядной диете выделяется больше растворённого органического углерода (РОУ) и аммония, чем при всеядной диете[97].
Микробная петля
Бактериальный лизис
Микробная петля — трофический путь в морской микробной пищевой сети, где растворённый органический углерод (РОУ) возвращается на более высокие трофические уровни посредством включения в бактериальную биомассу, а затем соединяется с классической пищевой цепью, образованной фитопланктоном — зоопланктоном — нектоном[101]. Растворённый органический углерод попадает в морскую среду в результате[102]:
- бактериального лизиса
- утечки или выделения фиксированного углерода из фитопланктона (например, слизистого экзополимера из диатомовых водорослей)
- внезапного старения клеток
- неаккуратного питания зоопланктоном
- выделения отходов водными животными
- распада или растворения органических частиц из наземных растений и почв.
Бактерии в микробной петле разлагают этот твердый детрит, чтобы использовать это богатое энергией вещество для роста. Поскольку более 95 % органического вещества в морских экосистемах состоит из полимерных высокомолекулярных соединений (например, белков, полисахаридов, липидов), лишь небольшая часть общего количества растворённого органического вещества (РОВ) легко усваивается большинством морских организмов на более высоких трофических уровнях. Растворённый органический углерод недоступен напрямую большинству морских организмов; морские бактерии вводят этот органический углерод в пищевую сеть, в результате чего дополнительная энергия становится доступной для более высоких трофических уровней[103].
Вирусный шунт
До 25 % первичной продукции фитопланктона в мировых океанах может быть повторно использовано в микробной петле посредством вирусного шунтирования[104]. Вирусный шунт — механизм предотвращения морскими вирусами миграции микробных частиц органического вещества (англ. POM) наверх по трофическим уровням, путём переработки их в растворённые органические вещества (РОВ, англ. DOM), которые могут легко усваиваться микроорганизмами. Количество РОВ (англ. DOM), переработанного вирусным путем, сопоставимо с другими основными источниками морского РОВ. Вирусы могут легко инфицировать микроорганизмы в микробной петле[105][106]. Смертность прокариот и эукариот способствует рециркуляции углеродных питательных веществ посредством лизиса клеток. Имеются также данные о регенерации азота (в частности, аммиака). Эта переработка питательных веществ стимулирует рост микроорганизмов.
Макроорганизмы
Желейное падение

Желейные водопады — явления морского круговорота углерода, при которых студенистый зоопланктон, в первую очередь стрекающие, опускается на морское дно и усиливает потоки углерода и азота[108], что обеспечивает питание бентической мегафауны и бактерий[109][110]. Желейные водопады — основной «студенистый путь» для секвестрации лабильного биогенного углерода через биологический насос[111]. Подобные явления часто встречаются на охраняемых территориях с высоким уровнем первичной продукции и качеством воды, подходящим для обитания стрекающих. Эти области включают эстуарии, и несколько исследований были проведены во фьордах Норвегии[110].
Китовый насос
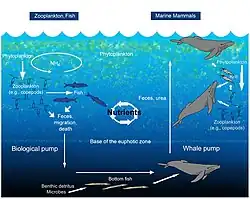
Киты и другие морские млекопитающие также повышают первичную продуктивность в своих районах нагула, концентрируя азот вблизи поверхности посредством выброса хлопьевидных фекальных шлейфов (китовые фекалии)[112]. Киты и тюлени пополняют запасы азота в эвфотической зоне залива Мэн в объёме, превышающем объём, поступающий из всех рек вместе взятых. Этот восходящий китовый насос играл гораздо большую роль до промышленного рыболовства, уничтожившего поголовье морских млекопитающих, когда рециркуляция азота в три раза превышала поступление азота из атмосферы[113].
Биологический насос обеспечивает удаление углерода и азота из эвфотической зоны посредством нисходящего потока агрегатов, фекалий и вертикальной миграции беспозвоночных и рыб[114]. Копеподы и другой зоопланктон производят фекальные гранулы и способствуют нисходящему переносу растворенных и твердых органических веществ путём дыхания и выделения на глубине во время циклов миграции, таким образом экспортируя питательные вещества (N, P и Fe) из поверхностных вод[115][116].
Зоопланктон питается в эвфотической зоне и экспортирует питательные вещества посредством тонущих фекальных гранул и вертикальной миграции. Рыбы выделяют питательные вещества на той же глубине, на которой они питаются. Выделения морских млекопитающих, привязанных к поверхности для дыхания, происходят на меньшей глубине, чем там, где они питаются.
Морские млекопитающие влияют на климат посредством процессов оплодотворения и переноса углерода из поверхностных вод в глубоководные районы моря через тонувшие туши китов (падение китов.[117]). В прибрежных районах киты повышают продуктивность экосистемы. Подсчитано, что с точки зрения поглощения углерода один кит эквивалентен тысячам деревьев[118]
Вертикальные миграции
Дневная вертикальная миграция криля, сальпы, мелкого зоопланктона и рыб активно переносит углерод на глубину. Они потребляют частицы органического углерода (англ. POC) в поверхностном слое ночью и метаболизируют его днём на глубинах мезопелагеля. В зависимости от жизненного цикла вида активный транспорт углерода может происходить также на сезонной основе.
Большую роль в активном транспорте фекальных гранул играют зоопланктон и сальпы. 15-50 % биомассы зоопланктона мигрирует, что обеспечивает перенос 5-45 % частиц органического азота на глубину[48]. У сальп очень долгое время задержки в кишечнике, поэтому фекальные гранулы обычно высвобождаются на максимальной глубине. Сальпы также известны тем, что имеют одни из самых крупных фекальных гранул. Из-за этого их фекалии очень быстро тонут, кроме того на них скапливаются мелкие частицы детрита. Из-за этого они тонут ещё быстрее. Таким образом, хотя в настоящее время все ещё проводится много исследований относительно того, почему организмы мигрируют вертикально, очевидно, что вертикальная миграция играет большую роль в активном переносе растворённого органического вещества на глубину[119].
Липидный насос
Липидный насос — перекачка углерода с поверхности океана в более глубокие воды с помощью липидов, связанных с зимующим вертикально мигрирующим зоопланктоном . Липиды богаты углеводородами, но бедны азотом и фосфором. Углерод, связанный с липидами, поступает в глубины океана в виде:
- углекислого газа, образующегося в результате дыхания липидных запасов
- органического вещества, образующегося в результате гибели зоопланктона.
По сравнению с более общим биологическим насосом, липидный насос также приводит к липидному шунтированию, при котором такие питательные вещества, такие как азот и фосфор, которые потребляются в избытке, выводятся обратно и, таким образом, не удаляются из поверхностного смешанного слоя океана[120]. Углерод, транспортируемый липидным насосом, не ограничивает доступность необходимых питательных веществ на поверхности океана. В биологическом насосе удаление питательных веществ всегда сопряжено с секвестрацией углерода; первичное производство ограничено, поскольку углерод и питательные вещества транспортируются на глубину вместе в форме органического вещества[120].
Углерод, транспортируемый на глубину более 1000 метров веслоногими рачками рода Calanus в Северном Ледовитом океане почти равен объёму, ежегодно переносимому на той же глубине органическим углеродом в виде частиц (англ. POC) в этом регионе[121]. Продолжаются исследования для более точной оценки количества, остающегося на глубине[120][121][122]. Скорость экспорта липидного насоса может варьироваться от 1 до 9,3 г С м −2 г −1 в умеренных и субполярных регионах, содержащих сезонно мигрирующий зоопланктон[122]. Потепление океанов и таяние ледяных шапок из-за изменения климата могут повлиять на организмы, связанные с липидным насосом, что повлияет на выживание многих промысловых рыб и находящихся под угрозой исчезновения морских млекопитающих[123][124][125]. Дальнейшие исследования липидного насоса повысят точность и общее понимание потоков углерода в глобальных океанических системах[120][121][122].
Биолюминесцентный шунт
Биолюминесцентные бактерии приобретаются хозяином (кальмаром, рыбой) из морской воды, пока они находятся в молоди, а затем регулярно выпускаются в океан.
Биолюминесцентный шунт в биологическом углеродном насосе в океане состоит из следующих стадий (на схеме справа):
- биолюминисцентные бактерии высвобождаются из кишечника в фекальные гранулы или в морскую воду (шаг 1).
- биолюминесцентные бактерии, колонизирующие фекальные гранулы и частицы, влияют на скорость потребления зоопланктоном, служа визуальными маркерами, усиливающими обнаружение («гипотеза приманки»), привлечение и, в конечном итоге, хищничество со стороны более высоких трофических уровней (шаг 2)
- в мезопелагической зоне зоопланктон и его хищники питаются тонущими светящимися частицами и фекальными гранулами, которые либо образуют агрегаты (переупаковка) с более высокой скоростью погружения, либо фрагментируют органическое вещество (из-за неаккуратного питания) с более низкой скоростью погружения (шаг 3)
- фильтраторы также агрегируют тонущую органику без особого визуального обнаружения и отбора светящихся веществ. Суточные (и сезонные) вертикальные мигранты, питающиеся светящейся пищей, метаболизируют и выделяют светящиеся фекальные гранулы с поверхности в мезопелагиаль (шаг 4)
- биолюминесцентные бактерии распространяются в больших пространственных масштабах. Люминесцентые бактерии, прикреплённые к частицам, опускаются на морское дно (шаг 5) и потребляются эпибентосными организмами.
Количественная оценка
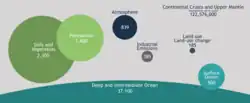
Геологическая составляющая углеродного цикла (более медленная по сравнению с другими частями глобального углеродного цикла)— один из важнейших факторов, определяющих количество углерода в атмосфере и, следовательно, глобальную температуру[128].
Процессы, формирующие биологический насос, как часть общего углеродного цикла, трудно измерить из-за того, что они обычно происходят на глубине. Распространённым методом является оценка первичной продукции, подпитываемой нитратами и аммонием.
На этой оценке основано вычисление f-коэффициента—показателя локальной мощности биологического насоса. Применение результатов локальных исследований в глобальном масштабе осложняется ролью, которую циркуляция океана играет в различных его регионах[129].
Последствия изменения климата
Увеличению концентрации CO2 в атмосфере происходит из-за:
- изменения в землепользовании
- сжигания ископаемого топлива
- производства цемента.
Одна треть (2 × 10 15 граммов углерода в год)[130] антропогенных выбросов CO 2 может попадать в океан[131]. Некоторые исследования показывают, что существует связь между повышенным уровнем CO2 и первичной морской продукцией.
.png)
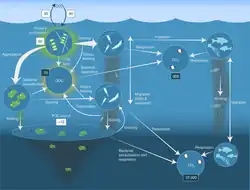
Изменение климата может повлиять на биологический насос в будущем, вызывая потепление и стратификацию поверхности океана. Предполагается снижение поступления питательных веществ в эвфотическую зону и, в результате, снижение там первичной продукции. Изменения в экологическом успехе кальцифицирующих организмов, вызванные закислением океана, могут повлиять на биологический насос, изменяя силу насоса твёрдых тканей[134]. Это может затем оказать «опосредованное» воздействие на насос мягких тканей, поскольку карбонат кальция действует как балласт, тонущая органическая материя.[135]
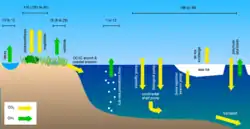
Вторая диаграмма справа показывает некоторые возможные последствия сокращения площади морского льда и таяния вечной мерзлоты для потоков углерода в Арктике. На суше растения поглощают углерод, а микроорганизмы в почве вырабатывают метан и дышат CO2 . Озёра являются чистыми источниками метана, а органический и неорганический углерод (растворённый и в виде частиц) поступает в океан через пресноводные системы. В океане метан может выделяться в результате таяния подводной вечной мерзлоты, а CO 2 поглощается из-за недонасыщенности CO 2 в воде по сравнению с атмосферой. Кроме того, многочисленные потоки тесно связаны с морским льдом. Наилучшие текущие оценки атмосферных потоков приводятся в Тг С год −1, где это возможно.
Биологический насос играл важную роль в колебаниях уровня CO2 в атмосфере в прошлые ледниковые и межледниковые периоды. Однако пока не ясно, как биологический насос отреагирует на будущее изменение климата[43]. Важно сначала расшифровать реакцию фитопланктона, одного из ключевых компонентов биологического насоса, на будущие изменения концентрации CO2 в атмосфере. Различные таксоны фитопланктона, вероятно, будут реагировать на изменение климата по-разному[91]. Например, ожидается снижение численности диатомовых водорослей из-за усиления стратификации в будущем океане[136]. Диатомовые водоросли очень эффективно транспортируют углерод на глубину, образуя крупные, быстро тонувшие агрегаты, а уменьшение их численности может, в свою очередь, привести к снижению экспорта углерода[49].
Снижение pH океана из-за его закисления может помешать кокколитофоридам образовывать известковые пластины, что может повлиять на биологический насос[91], при этом чувствительность видов разная[137].
Концентрации кокколитофорид в Северной Атлантике увеличились на порядок с 1960-х годов, наиболее вероятной причиной названо увеличение поглощенного CO2, а также повышение температуры.[138]
В исследовании 2017 года учёные использовали моделирование распределения видов (SDM) для прогнозирования будущего глобального распределения двух видов фитопланктона, важных для биологического насоса: диатомовой водоросли Chaetoceros diadema и кокколитофориды Emiliania huxleyi[139]. Было предсказано, что изменения в ареале и распределении этих двух видов фитопланктона в этих будущих условиях океана, если они осуществятся, могут привести к снижению вклада в секвестрацию углерода через биологический насос. В 2019 году исследование показало, что при нынешних темпах закисления морской воды мы можем увидеть, как антарктический фитопланктон станет меньше и менее эффективно удерживать углерод к концу столетия[140].
Мониторинг

Для мониторинга биологического насоса используются различные методы, которые могут быть развернуты с различных платформ, таких как корабли, автономные транспортные средства и спутники. В настоящее время спутниковое дистанционное зондирование является единственным доступным инструментом для просмотра всей поверхности океана в высоких временных и пространственных масштабах.
Необходимое исследование

Правильное понимание биологического насоса требует многопрофильных наблюдений в глубоководной толще[142]:
- Физика: стратификация влияет на погружение частиц; понимание происхождения частиц и времени пребывания DIC в результате реминерализации частиц в глубоком океане требует измерения адвекции и смешивания.
- Биогеохимия: вынос/смешивание твердых частиц и растворенных органических веществ из поверхностного слоя определяет поступление лабильных органических веществ на морское дно, которые либо усваиваются биотой морского дна, либо сохраняются в течение более длительного времени в осадке.
- Биология и экосистемы: зоопланктон и микроорганизмы разлагают и реминерализуют тонувшие частицы в толще воды. Экспортируемое органическое вещество питает всю водную толщу и бентосную биоту (зоопланктон, бентосные беспозвоночные, микробы), поддерживая их биомассу, плотность и биоразнообразие.
См. также
Примечания
- 1 2 Hain, M.P. The Biological Pump in the Past // Treatise on Geochemistry / M.P. Hain, D.M. Sigman, G.H. Haug. — 2. — 2014. — Vol. 8. — P. 485–517. — ISBN 9780080983004. — doi:10.1016/B978-0-08-095975-7.00618-5.
- ↑ Nowicki, Michael; DeVries, Tim; Siegel, David A. (March 2022). Quantifying the Carbon Export and Sequestration Pathways of the Ocean's Biological Carbon Pump. Global Biogeochemical Cycles. 36 (3). Bibcode:2022GBioC..3607083N. doi:10.1029/2021GB007083. S2CID 246458736.
- ↑ Volk, Tyler. Ocean Carbon Pumps: Analysis of Relative Strengths and Efficiencies in Ocean-Driven Atmospheric CO2 Changes // The Carbon Cycle and Atmospheric CO2 : Natural Variations Archean to Present / Tyler Volk, Martin I. Hoffert. — 2013. — P. 99–110. — ISBN 9781118664322. — doi:10.1029/GM032p0099.
- 1 2 Sarmiento, Jorge L. Ocean Biogeochemical Dynamics. — Princeton University Press, 17 July 2013. — P. 526. — ISBN 9781400849079.
- 1 2 3 4 5 6 7 de la Rocha, C.L. The Biological Pump // Treatise on Geochemistry / C.L. de la Rocha, U. Passow. — 2014. — P. 93–122. — ISBN 9780080983004. — doi:10.1016/B978-0-08-095975-7.00604-5.
- ↑ Sigman, D.M.; Hain, M.P. (2012). The Biological Productivity of the Ocean (PDF). Nature Education Knowledge. 3 (6): 1–16. Дата обращения: 1 июня 2015.
The value of NEP [Net Ecosystem Production] depends on the boundaries defined for the ecosystem. If one considers the sunlit surface ocean down to the 1% light level (the "euphotic zone") over the course of an entire year, then NEP is equivalent to the particulate organic carbon sinking into the dark ocean interior plus the dissolved organic carbon being circulated out of the euphotic zone. In this case, NEP is also often referred to as "export production" (or "new production" (Dugdale & Goering 1967), as discussed below).
- ↑ Martiny, Adam C.; Pham, Chau T. A.; Primeau, Francois W.; Vrugt, Jasper A.; Moore, J. Keith; Levin, Simon A.; Lomas, Michael W. (April 2013). Strong latitudinal patterns in the elemental ratios of marine plankton and organic matter. Nature Geoscience. 6 (4): 279–283. Bibcode:2013NatGe...6..279M. doi:10.1038/NGEO1757. S2CID 5677709.
- ↑ Heinrichs, Mara E.; Mori, Corinna; Dlugosch, Leon. Complex Interactions Between Aquatic Organisms and Their Chemical Environment Elucidated from Different Perspectives (англ.) // YOUMARES 9 - the Oceans: Our Research, Our Future. — 2020. — P. 279–297. — ISBN 978-3-030-20388-7. — doi:10.1007/978-3-030-20389-4_15.
- ↑ Carlson CA (2002) [books.google.com/books?id=D6TMKZOgldAC&q=%22Production+and+removal+processes%22&pg=PA91 «Production and removal processes»]. In: Hansell DA, Carlson CA (eds) Biogeochemistry of marine dissolved organic matter. Academic Press, San Diego, pages 91-151. ISBN 9780123238412.
- ↑ Hedges, John I. (1992). Global biogeochemical cycles: progress and problems. Marine Chemistry. 39 (1–3). Elsevier BV: 67–93. Bibcode:1992MarCh..39...67H. doi:10.1016/0304-4203(92)90096-s. ISSN 0304-4203.
- ↑ Zeebe, Richard E. CO2 in seawater : equilibrium, kinetics, isotopes / Richard E. Zeebe, Dieter A. Wolf-Gladrow. — 2001. — P. 65. — ISBN 978-0-08-052922-6.
- ↑ Rost, Björn. Coccolithophores and the biological pump: Responses to environmental changes // Coccolithophores / Björn Rost, Ulf Riebesell. — Springer Berlin Heidelberg, 2004. — P. 99–125. — ISBN 978-3-642-06016-8. — doi:10.1007/978-3-662-06278-4_5.
- ↑ Zeebe, Richard E. (30 мая 2012). History of Seawater Carbonate Chemistry, Atmospheric CO2, and Ocean Acidification. Annual Review of Earth and Planetary Sciences. 40 (1). Annual Reviews: 141–165. Bibcode:2012AREPS..40..141Z. doi:10.1146/annurev-earth-042711-105521. ISSN 0084-6597.
- 1 2 Hansell, Dennis A.; Carlson, Craig A. (12 августа 2013). Localized refractory dissolved organic carbon sinks in the deep ocean. Global Biogeochemical Cycles. 27 (3). American Geophysical Union (AGU): 705–710. doi:10.1002/gbc.20067. ISSN 0886-6236. S2CID 17175370.
- 1 2 Hansell, Dennis A. (3 января 2013). Recalcitrant Dissolved Organic Carbon Fractions. Annual Review of Marine Science. 5 (1). Annual Reviews: 421–445. doi:10.1146/annurev-marine-120710-100757. ISSN 1941-1405. PMID 22881353.
- ↑ Williams, Peter M.; Druffel, Ellen R. M. (1987). Radiocarbon in dissolved organic matter in the central North Pacific Ocean. Nature. 330 (6145). Springer Science and Business Media LLC: 246–248. Bibcode:1987Natur.330..246W. doi:10.1038/330246a0. ISSN 0028-0836. S2CID 4329024.
- ↑ Druffel, E. R. M.; Griffin, S.; Coppola, A. I.; Walker, B. D. (28 мая 2016). Radiocarbon in dissolved organic carbon of the Atlantic Ocean. Geophysical Research Letters. 43 (10). American Geophysical Union (AGU): 5279–5286. Bibcode:2016GeoRL..43.5279D. doi:10.1002/2016gl068746. ISSN 0094-8276. S2CID 56069589.
- ↑ Stramska, Malgorzata; Cieszyńska, Agata (18 июля 2015). Ocean colour estimates of particulate organic carbon reservoirs in the global ocean – revisited. International Journal of Remote Sensing. 36 (14). Informa UK Limited: 3675–3700. Bibcode:2015IJRS...36.3675S. doi:10.1080/01431161.2015.1049380. ISSN 0143-1161. S2CID 128524215.
- ↑ Sarmiento, Jorge L. Ocean Biogeochemical Dynamics. — Princeton University Press, 2006-01-01. — ISBN 978-1-4008-4907-9. — doi:10.1515/9781400849079.
- ↑ Longhurst, Alan; Sathyendranath, Shubha; Platt, Trevor; Caverhill, Carla (1995). An estimate of global primary production in the ocean from satellite radiometer data. Journal of Plankton Research. 17 (6). Oxford University Press (OUP): 1245–1271. doi:10.1093/plankt/17.6.1245. ISSN 0142-7873.
- ↑ Sathyendranath, S. Primary Production Distribution // Encyclopedia of Ocean Sciences / S. Sathyendranath, T. Platt, Robert J.W. Brewin … [и др.]. — Elsevier, 2019. — P. 635–640. — ISBN 9780128130827. — doi:10.1016/b978-0-12-409548-9.04304-9.
- ↑ Kulk, Gemma; Platt, Trevor; Dingle, James; Jackson, Thomas; et al. (3 марта 2020). Primary Production, an Index of Climate Change in the Ocean: Satellite-Based Estimates over Two Decades. Remote Sensing. 12 (5). MDPI AG: 826. Bibcode:2020RemS...12..826K. doi:10.3390/rs12050826. ISSN 2072-4292.
{{cite journal}}:|hdl-access=требует|hdl=(справка) - ↑ Hopkins, Jason; Henson, Stephanie A.; Poulton, Alex J.; Balch, William M. (2019). Regional Characteristics of the Temporal Variability in the Global Particulate Inorganic Carbon Inventory. Global Biogeochemical Cycles. 33 (11). American Geophysical Union (AGU): 1328–1338. Bibcode:2019GBioC..33.1328H. doi:10.1029/2019gb006300. ISSN 0886-6236. S2CID 210342576.
- 1 2 Feely, Richard A.; Sabine, Christopher L.; Lee, Kitack; Berelson, Will; Kleypas, Joanie; Fabry, Victoria J.; Millero, Frank J. (16 июля 2004). Impact of Anthropogenic CO 2 on the CaCO 3 System in the Oceans. Science. 305 (5682). American Association for the Advancement of Science (AAAS): 362–366. Bibcode:2004Sci...305..362F. doi:10.1126/science.1097329. ISSN 0036-8075. PMID 15256664. S2CID 31054160.
- ↑ Schiebel, Ralf (24 октября 2002). Planktic foraminiferal sedimentation and the marine calcite budget. Global Biogeochemical Cycles. 16 (4). American Geophysical Union (AGU): 3–1–3–21. Bibcode:2002GBioC..16.1065S. doi:10.1029/2001gb001459. ISSN 0886-6236. S2CID 128737252.
- ↑ Riebesell, Ulf; Zondervan, Ingrid; Rost, Björn; Tortell, Philippe D.; Zeebe, Richard E.; Morel, François M. M. (2000). Reduced calcification of marine plankton in response to increased atmospheric CO2 (PDF). Nature. 407 (6802). Springer Science and Business Media LLC: 364–367. Bibcode:2000Natur.407..364R. doi:10.1038/35030078. ISSN 0028-0836. PMID 11014189. S2CID 4426501.
- ↑ Mitchell, C.; Hu, C.; Bowler, B.; Drapeau, D.; Balch, W. M. (2017). Estimating Particulate Inorganic Carbon Concentrations of the Global Ocean from Ocean Color Measurements Using a Reflectance Difference Approach. Journal of Geophysical Research: Oceans. 122 (11): 8707–8720. Bibcode:2017JGRC..122.8707M. doi:10.1002/2017JC013146.
- ↑ Wilson, R. W.; Millero, F. J.; Taylor, J. R.; Walsh, P. J.; Christensen, V.; Jennings, S.; Grosell, M. (2009-01-16). Contribution of Fish to the Marine Inorganic Carbon Cycle. Science. 323 (5912): 359–362. Bibcode:2009Sci...323..359W. doi:10.1126/science.1157972. PMID 19150840. S2CID 36321414.
- ↑ Hain, M.P.; Sigman, D.M.; Haug, G.H. (2010). Carbon dioxide effects of Antarctic stratification, North Atlantic Intermediate Water formation, and subantarctic nutrient drawdown during the last ice age: Diagnosis and synthesis in a geochemical box model. Global Biogeochemical Cycles. 24 (4): 1–19. Bibcode:2010GBioC..24.4023H. doi:10.1029/2010GB003790.
- ↑ H., Schlesinger, William. Biogeochemistry : an analysis of global change. — 3rd. — Waltham, Mass. : Academic Press, 2013. — ISBN 9780123858740.
- ↑ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P. (13 октября 2000). The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System. Science (англ.). 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. ISSN 0036-8075. PMID 11030643.
- ↑ Raven, J. A.; P. G. Falkowski (1999). Oceanic sinks for atmospheric CO2. Plant, Cell and Environment. 22 (6): 741–755. doi:10.1046/j.1365-3040.1999.00419.x.
- ↑ Raven, J. A.; Falkowski, P. G. (1999). Oceanic sinks for atmospheric CO2. Plant, Cell and Environment. 22 (6): 741–755. doi:10.1046/j.1365-3040.1999.00419.x.
- ↑ Hain, M.P.; Sigman, D.M.; Haug, G.H (2014). The Biological Pump in the Past. Treatise on Geochemistry. 8: 485–517. doi:10.1016/B978-0-08-095975-7.00618-5. ISBN 9780080983004.
- 1 2 Rost, Bjorn. Coccolithophores and the biological pump: responses to environmental changes / Bjorn Rost, Ulf Reibessel. — Berlin, Heidelberg : Springer, 2004. — ISBN 978-3-642-06016-8.
- 1 2 3 Tsunogai, S.; Watanabe, S.; Sato, T. (1999). Is there a "continental shelf pump" for the absorption of atmospheric CO2. Tellus B. 51 (3): 701–712. Bibcode:1999TellB..51..701T. doi:10.1034/j.1600-0889.1999.t01-2-00010.x.
- ↑ Rippeth, T. P.; Scourse, J. D.; Uehara, K.; McKeown, S. (2008). Impact of sea-level rise over the last deglacial transition on the strength of the continental shelf CO2 pump. Geophys. Res. Lett. 35 (24): L24604. Bibcode:2008GeoRL..3524604R. doi:10.1029/2008GL035880. S2CID 1049049.
- ↑ Cavan, EL, Belcher, A., Atkinson, A., Hill, SL, Kawaguchi, S., McCormack, S., Meyer, B., Nicol, S., Ratnarajah, L., Schmidt, K. и Steinberg, DK. The importance of Antarctic krill in biogeochemical cycles (англ.) // Nature Communications : журнал. — 2019. — Vol. 10, no. 4742. — P. 1—13. — doi:10.1038/s41467-019-12668-7.
- ↑ Lampitt, R. S.; Noji, T.; von Bodungen, B. (1990). What happens to zooplankton faecal pellets? Implications for material flux. Marine Biology. 104 (1): 15–23. Bibcode:1990MarBi.104...15L. doi:10.1007/BF01313152. S2CID 86523326.
- ↑ Bishop, James (2009). Autonomous Observations of the Ocean Biological Carbon Pump. Oceanography. 22 (2): 182–193. doi:10.5670/oceanog.2009.48.
- 1 2 Chisholm, Sallie W. (1995). The iron hypothesis: Basic research meets environmental policy. Reviews of Geophysics. 33 (S2): 1277–1286. Bibcode:1995RvGeo..33S1277C. doi:10.1029/95RG00743.
- ↑ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Högberg, P.; Linder, S.; MacKenzie, F. T.; Moore b, 3rd; Pedersen, T.; Rosenthal, Y.; Seitzinger, S. (2000). The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System. Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. PMID 11030643.
{{cite journal}}: Википедия:Обслуживание CS1 (числовые имена: authors list) (ссылка) - 1 2 3 4 5 6 Turner, Jefferson T. (2015). Zooplankton fecal pellets, marine snow, phytodetritus and the ocean's biological pump. Progress in Oceanography. 130: 205–248. Bibcode:2015PrOce.130..205T. doi:10.1016/j.pocean.2014.08.005.
- 1 2 Kim, Ja-Myung; Lee, Kitack; Shin, Kyungsoon; Yang, Eun Jin; Engel, Anja; Karl, David M.; Kim, Hyun-Cheol (2011). Shifts in biogenic carbon flow from particulate to dissolved forms under high carbon dioxide and warm ocean conditions. Geophysical Research Letters. 38 (8): n/a. Bibcode:2011GeoRL..38.8612K. doi:10.1029/2011GL047346.
- ↑ Hansell, Dennis; Carlson, Craig; Repeta, Daniel; Schlitzer, Reiner (2009). Dissolved Organic Matter in the Ocean: A Controversy Stimulates New Insights. Oceanography. 22 (4): 202–211. doi:10.5670/oceanog.2009.109.
{{cite journal}}:|hdl-access=требует|hdl=(справка) - ↑ Carlson, Craig A.; Ducklow, Hugh W.; Michaels, Anthony F. (1994). Annual flux of dissolved organic carbon from the euphotic zone in the northwestern Sargasso Sea. Nature. 371 (6496): 405–408. Bibcode:1994Natur.371..405C. doi:10.1038/371405a0. S2CID 4279712.
- ↑ Roshan, Saeed; Devries, Timothy (2017). Efficient dissolved organic carbon production and export in the oligotrophic ocean. Nature Communications. 8 (1): 2036. Bibcode:2017NatCo...8.2036R. doi:10.1038/s41467-017-02227-3. PMC 5725454. PMID 29230041.
- 1 2 Steinberg, Deborah; Sarah Goldthwait; Dennis Hansell (2002). Zooplankton vertical migration and the active transport of dissolved organic and inorganic nitrogen in the Sargasso Sea. Deep-Sea Research Part I. 49 (8): 1445–1461. Bibcode:2002DSRI...49.1445S. CiteSeerX 10.1.1.391.7622. doi:10.1016/S0967-0637(02)00037-7. ISSN 0967-0637.
- 1 2 3 4 5 6 Passow, U.; Carlson, CA (2012). The biological pump in a high CO2 world. Marine Ecology Progress Series. 470: 249–271. Bibcode:2012MEPS..470..249P. doi:10.3354/meps09985.
- ↑ Robinson, J.; Popova, E.E.; Yool, A.; Srokosz, M.A.; Lampitt, R.S.; Blundell, J.R. (2014). How deep is deep enough? Ocean iron fertilization and carbon sequestration in the Southern Ocean (PDF). Geophys. Res. Lett. 41 (7): 2489–2495. Bibcode:2014GeoRL..41.2489R. doi:10.1002/2013GL058799.
- ↑ Falkowski, P. G.; Barber, R. T.; Smetacek v, V. (1998). Biogeochemical Controls and Feedbacks on Ocean Primary Production. Science. 281 (5374): 200–206. doi:10.1126/science.281.5374.200. PMID 9660741.
- ↑ Yool, Andrew; Martin, Adrian P.; Fernández, Camila; Clark, Darren R. (2007). The significance of nitrification for oceanic new production. Nature. 447 (7147): 999–1002. Bibcode:2007Natur.447..999Y. doi:10.1038/nature05885. PMID 17581584. S2CID 4416535.
- ↑ Simon, M.; Grossart, HP; Schweitzer, B.; Ploug, H. (2002). Microbial ecology of organic aggregates in aquatic ecosystems. Aquatic Microbial Ecology. 28: 175–211. doi:10.3354/ame028175.
- ↑ Azam, F.; Fenchel, T.; Field, JG; Gray, JS; Meyer-Reil, LA; Thingstad, F. (1983). The Ecological Role of Water-Column Microbes in the Sea. Marine Ecology Progress Series. 10: 257–263. Bibcode:1983MEPS...10..257A. doi:10.3354/meps010257.
- ↑ Ionescu, Danny; Bizic-Ionescu, Mina; Khalili, Arzhang; Malekmohammadi, Reza; Morad, Mohammad Reza; De Beer, Dirk; Grossart, Hans-Peter. A new tool for long-term studies of POM-bacteria interactions: Overcoming the century-old Bottle Effect (англ.) // Scientific Reports : журнал. — 2015. — Vol. 5: 14706. — doi:10.1038/srep14706. — . — PMID 26435525. — PMC 4592964.
- ↑ Iversen, M. H.; Ploug, H. Ballast minerals and the sinking carbon flux in the ocean: Carbon-specific respiration rates and sinking velocities of macroscopic organic aggregates (Marine snow). doi:10.5194/bgd-7-3335-2010.
{{cite journal}}: Cite journal требует|journal=(справка) Modified text was copied from this source, which is available under a Creative Commons Attribution 3.0 International License.
Modified text was copied from this source, which is available under a Creative Commons Attribution 3.0 International License. - ↑ Alldredge, Alice L.; Silver, Mary W. (1988). Characteristics, dynamics and significance of marine snow. Progress in Oceanography. 20 (1): 41–82. Bibcode:1988PrOce..20...41A. doi:10.1016/0079-6611(88)90053-5.
- 1 2 3 Armstrong, Robert A.; Lee, Cindy; Hedges, John I.; Honjo, Susumu; Wakeham, Stuart G. (2001). A new, mechanistic model for organic carbon fluxes in the ocean based on the quantitative association of POC with ballast minerals. Deep Sea Research Part II: Topical Studies in Oceanography. 49 (1–3): 219–236. Bibcode:2001DSRII..49..219A. doi:10.1016/S0967-0645(01)00101-1.
- 1 2 Francois, Roger; Honjo, Susumu; Krishfield, Richard; Manganini, Steve (2002). Factors controlling the flux of organic carbon to the bathypelagic zone of the ocean. Global Biogeochemical Cycles. 16 (4): 34—1-34-20. Bibcode:2002GBioC..16.1087F. doi:10.1029/2001GB001722. S2CID 128876389.
- 1 2 3 Klaas, Christine; Archer, David E. (2002). Association of sinking organic matter with various types of mineral ballast in the deep sea: Implications for the rain ratio. Global Biogeochemical Cycles. 16 (4): 63—1-63-14. Bibcode:2002GBioC..16.1116K. doi:10.1029/2001GB001765.
- ↑ Le Moigne, Frédéric A. C.; Pabortsava, Katsiaryna; Marcinko, Charlotte L. J.; Martin, Patrick; Sanders, Richard J. (2014). Where is mineral ballast important for surface export of particulate organic carbon in the ocean?. Geophysical Research Letters. 41 (23): 8460–8468. Bibcode:2014GeoRL..41.8460L. doi:10.1002/2014GL061678. PMC 4459180. PMID 26074644.
- ↑ Iversen, Morten H.; Robert, Maya L. (2015). Ballasting effects of smectite on aggregate formation and export from a natural plankton community. Marine Chemistry. 175: 18–27. Bibcode:2015MarCh.175...18I. doi:10.1016/j.marchem.2015.04.009.
- 1 2 Ploug, Helle; Iversen, Morten Hvitfeldt; Koski, Marja; Buitenhuis, Erik Theodoor (2008). Production, oxygen respiration rates, and sinking velocity of copepod fecal pellets: Direct measurements of ballasting by opal and calcite. Limnology and Oceanography. 53 (2): 469–476. Bibcode:2008LimOc..53..469P. doi:10.4319/lo.2008.53.2.0469.
- ↑ Engel, Anja; Abramson, Lynn; Szlosek, Jennifer; Liu, Zhanfei; Stewart, Gillian; Hirschberg, David; Lee, Cindy (2009). Investigating the effect of ballasting by CaCO3 in Emiliania huxleyi, II: Decomposition of particulate organic matter. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (18): 1408–1419. Bibcode:2009DSRII..56.1408E. doi:10.1016/j.dsr2.2008.11.028.
- ↑ Engel, Anja; Szlosek, Jennifer; Abramson, Lynn; Liu, Zhanfei; Lee, Cindy (2009). Investigating the effect of ballasting by CaCO3 in Emiliania huxleyi: I. Formation, settling velocities and physical properties of aggregates. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (18): 1396–1407. Bibcode:2009DSRII..56.1396E. doi:10.1016/j.dsr2.2008.11.027.
- ↑ Lee, Cindy; Peterson, Michael L.; Wakeham, Stuart G.; Armstrong, Robert A.; Cochran, J. Kirk; Miquel, Juan Carlos; Fowler, Scott W.; Hirschberg, David; Beck, Aaron; Xue, Jianhong (2009). Particulate organic matter and ballast fluxes measured using time-series and settling velocity sediment traps in the northwestern Mediterranean Sea. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (18): 1420–1436. Bibcode:2009DSRII..56.1420L. doi:10.1016/j.dsr2.2008.11.029.
- 1 2 Passow, Uta; de la Rocha, Christina L. (2006). Accumulation of mineral ballast on organic aggregates. Global Biogeochemical Cycles. 20 (1): n/a. Bibcode:2006GBioC..20.1013P. doi:10.1029/2005GB002579.
- ↑ Thomas, Helmuth; Bozec, Yann; Elkalay, Khalid; Baar, Hein J. W. de (2004-05-14). Enhanced Open Ocean Storage of CO2 from Shelf Sea Pumping (PDF). Science (англ.). 304 (5673): 1005–1008. Bibcode:2004Sci...304.1005T. doi:10.1126/science.1095491. ISSN 0036-8075. PMID 15143279. S2CID 129790522.
{{cite journal}}:|hdl-access=требует|hdl=(справка) - ↑ De La Rocha, C. L. The Biological Pump // Treatise on Geochemistry / Holland ; Turekian. — Pergamon Press, 2006. — Vol. 6. — P. 625. — ISBN 978-0-08-043751-4. — doi:10.1016/B0-08-043751-6/06107-7.
- ↑ Feely, Richard A.; Sabine, Christopher L.; Schlitzer, Reiner; Bullister, John L.; Mecking, Sabine; Greeley, Dana (2004-02-01). Oxygen Utilization and Organic Carbon Remineralisation in the Upper Water Column of the Pacific Ocean. Journal of Oceanography (англ.). 60 (1): 45–52. Bibcode:2004JOce...60...45F. doi:10.1023/B:JOCE.0000038317.01279.aa. ISSN 0916-8370. S2CID 67846685.
- ↑ Administration, US Department of Commerce, National Oceanic and Atmospheric. How far does light travel in the ocean? (амер. англ.). oceanservice.noaa.gov. Дата обращения: 29 февраля 2016.
- ↑ Karl, David M.; Knauer, George A.; Martin, John H. (1988-03-01). Downward flux of particulate organic matter in the ocean: a particle decomposition paradox. Nature. 332 (6163): 438–441. Bibcode:1988Natur.332..438K. doi:10.1038/332438a0. ISSN 0028-0836. S2CID 4356597.
- ↑ Lefévre, D.; Denis, M.; Lambert, C. E.; Miquel, J. -C. (1996-02-01). Is DOC the main source of organic matter remineralization in the ocean water column?. Journal of Marine Systems. The Coastal Ocean in a Global Change Perspective. 7 (2–4): 281–291. Bibcode:1996JMS.....7..281L. doi:10.1016/0924-7963(95)00003-8.
- ↑ Schulze, Ernst-Detlef. Biodiversity and Ecosystem Function : [англ.] / Ernst-Detlef Schulze, Harold A. Mooney. — Springer Science & Business Media, 6 December 2012. — ISBN 978-3-642-58001-7.
- ↑ International Census of Marine Microbes (ICoMM). www.coml.org. Дата обращения: 29 февраля 2016. Архивировано из оригинала 17 марта 2016 года.
- ↑ Microbe Size - Boundless Open Textbook. Boundless. Дата обращения: 29 февраля 2016.
- ↑ Baumert, Helmut Z.; Petzoldt, Thomas (2008). The role of temperature, cellular quota and nutrient concentrations for photosynthesis, growth and light–dark acclimation in phytoplankton. Limnologica. 38 (3–4): 313–326. Bibcode:2008Limng..38..313B. doi:10.1016/j.limno.2008.06.002.
- ↑ Lam, Man Kee; Lee, Keat Teong; Mohamed, Abdul Rahman (2012). Current status and challenges on microalgae-based carbon capture. International Journal of Greenhouse Gas Control. 10: 456–469. Bibcode:2012IJGGC..10..456L. doi:10.1016/j.ijggc.2012.07.010.
- 1 2 Häder, Donat-P.; Villafañe, Virginia E.; Helbling, E. Walter (2014). Productivity of aquatic primary producers under global climate change. Photochem. Photobiol. Sci. 13 (10): 1370–1392. doi:10.1039/C3PP50418B. PMID 25191675. S2CID 25740029.
{{cite journal}}:|hdl-access=требует|hdl=(справка) - 1 2 Li, Wei; Gao, Kunshan; Beardall, John (2012). Interactive Effects of Ocean Acidification and Nitrogen-Limitation on the Diatom Phaeodactylum tricornutum. PLOS ONE. 7 (12): e51590. Bibcode:2012PLoSO...751590L. doi:10.1371/journal.pone.0051590. PMC 3517544. PMID 23236517.
- 1 2 Hülse, Dominik; Arndt, Sandra; Wilson, Jamie D.; Munhoven, Guy; Ridgwell, Andy (2017). Understanding the causes and consequences of past marine carbon cycling variability through models (PDF). Earth-Science Reviews. 171: 349–382. Bibcode:2017ESRv..171..349H. doi:10.1016/j.earscirev.2017.06.004.
- ↑ Hutchins, David A.; Fu, Feixue (2017). Microorganisms and ocean global change. Nature Microbiology. 2 (6): 17058. doi:10.1038/nmicrobiol.2017.58. PMID 28540925. S2CID 23357501.
- ↑ Sanders, Richard; Henson, Stephanie A.; Koski, Marja; de la Rocha, Christina L.; Painter, Stuart C.; Poulton, Alex J.; Riley, Jennifer; Salihoglu, Baris; Visser, Andre; Yool, Andrew; Bellerby, Richard; Martin, Adrian P. (2014). The Biological Carbon Pump in the North Atlantic. Progress in Oceanography. 129: 200–218. Bibcode:2014PrOce.129..200S. doi:10.1016/j.pocean.2014.05.005.
- ↑ Boyd, Philip W. (2015). Toward quantifying the response of the oceans' biological pump to climate change. Frontiers in Marine Science. 2. doi:10.3389/fmars.2015.00077. S2CID 16787695.
- 1 2 3 Buesseler, Ken O.; Boyd, Philip W. (2009). Shedding light on processes that control particle export and flux attenuation in the twilight zone of the open ocean. Limnology and Oceanography. 54 (4): 1210–1232. Bibcode:2009LimOc..54.1210B. doi:10.4319/lo.2009.54.4.1210.
- 1 2 3 Herndl, Gerhard J.; Reinthaler, Thomas (2013). Microbial control of the dark end of the biological pump. Nature Geoscience. 6 (9): 718–724. Bibcode:2013NatGe...6..718H. doi:10.1038/ngeo1921. PMC 3972885. PMID 24707320.
- ↑ Hofmann, M.; Schellnhuber, H.-J. (2009). Oceanic acidification affects marine carbon pump and triggers extended marine oxygen holes. Proceedings of the National Academy of Sciences. 106 (9): 3017–3022. Bibcode:2009PNAS..106.3017H. doi:10.1073/pnas.0813384106. PMC 2642667. PMID 19218455.
- ↑ de la Rocha, Christina L.; Passow, Uta (2007). Factors influencing the sinking of POC and the efficiency of the biological carbon pump (PDF). Deep Sea Research Part II: Topical Studies in Oceanography. 54 (5–7): 639–658. Bibcode:2007DSRII..54..639D. doi:10.1016/j.dsr2.2007.01.004.
- ↑ Sato, R.; Tanaka, Y.; Ishimaru, T. (2003). Species-specific house productivity of appendicularians. Marine Ecology Progress Series. 259: 163–172. Bibcode:2003MEPS..259..163S. doi:10.3354/meps259163.
- ↑ Nishibe, Yuichiro; Takahashi, Kazutaka; Ichikawa, Tadafumi; Hidaka, Kiyotaka; Kurogi, Hiroaki; Segawa, Kyohei; Saito, Hiroaki (2015). Degradation of discarded appendicularian houses by oncaeid copepods. Limnology and Oceanography. 60 (3): 967–976. Bibcode:2015LimOc..60..967N. doi:10.1002/lno.10061.
- 1 2 3 4 5 6 7 Collins, Sinéad; Rost, Björn; Rynearson, Tatiana A. (2014). Evolutionary potential of marine phytoplankton under ocean acidification. Evolutionary Applications. 7 (1): 140–155. Bibcode:2014EvApp...7..140C. doi:10.1111/eva.12120. PMC 3894903. PMID 24454553.
- 1 2 Richardson, T. L.; Jackson, G. A. (2007). Small Phytoplankton and Carbon Export from the Surface Ocean. Science. 315 (5813): 838–840. Bibcode:2007Sci...315..838R. doi:10.1126/science.1133471. PMID 17289995. S2CID 45563491.
- 1 2 Ragueneau, Olivier; Schultes, Sabine; Bidle, Kay; Claquin, Pascal; Moriceau, Brivaëla (2006). Si and C interactions in the world ocean: Importance of ecological processes and implications for the role of diatoms in the biological pump. Global Biogeochemical Cycles. 20 (4): n/a. Bibcode:2006GBioC..20.4S02R. doi:10.1029/2006GB002688.
- ↑ Miklasz, Kevin A.; Denny, Mark W. (2010). Diatom sinkings speeds: Improved predictions and insight from a modified Stokes' law. Limnology and Oceanography. 55 (6): 2513–2525. Bibcode:2010LimOc..55.2513M. doi:10.4319/lo.2010.55.6.2513.
- ↑ Belcher, Anna; Manno, Clara; Ward, Peter; Henson, Stephanie A.; Sanders, Richard; Tarling, Geraint A. Copepod faecal pellet transfer through the meso- and bathypelagic layers in the Southern Ocean in spring // Biogeosciences. — 2017. — Т. 14 (6). — С. 1511–1525. — doi:10.5194/bg-14-1511-2017. — .
- ↑ Saba, Grace K.; Steinberg, Deborah K.; Bronk, Deborah A. (2011). The relative importance of sloppy feeding, excretion, and fecal pellet leaching in the release of dissolved carbon and nitrogen by Acartia tonsa copepods. Journal of Experimental Marine Biology and Ecology. 404 (1–2): 47–56. Bibcode:2011JEMBE.404...47S. doi:10.1016/j.jembe.2011.04.013.
- 1 2 Thor, P.; Dam, HG; Rogers, DR (2003). Fate of organic carbon released from decomposing copepod fecal pellets in relation to bacterial production and ectoenzymatic activity. Aquatic Microbial Ecology. 33: 279–288. doi:10.3354/ame033279.
- ↑ Hansell, Dennis A. Biogeochemistry of Marine Dissolved Organic Matter / Dennis A. Hansell, Craig A. Carlson. — Academic Press, 2 October 2014. — ISBN 9780124071537.
- ↑ Moller, E. F. (2004). Sloppy feeding in marine copepods: Prey-size-dependent production of dissolved organic carbon. Journal of Plankton Research. 27: 27–35. doi:10.1093/plankt/fbh147.
- ↑ Møller, Eva Friis (2007). Production of dissolved organic carbon by sloppy feeding in the copepods Acartia tonsa, Centropages typicus, and Temora longicornis. Limnology and Oceanography. 52 (1): 79–84. Bibcode:2007LimOc..52...79M. doi:10.4319/lo.2007.52.1.0079.
- ↑ Azam, Farooq; Fenchel, Tom; Field, J.G.; Gray, J.S.; Meyer-Reil, L.A.; Thingstad, F. (1983). The Ecological Role of Water-Column Microbes in the Sea. Marine Ecology Progress Series. 10: 257–263. Bibcode:1983MEPS...10..257A. doi:10.3354/meps010257.
- ↑ Van den Meersche, Karel; Middelburg, Jack J.; Soetaert, Karline; van Rijswijk, Pieter; Boschker, Henricus T. S.; Heip, Carlo H. R. (2004). Carbon-nitrogen coupling and algal-bacterial interactions during an experimental bloom: Modeling a13C tracer experiment. Limnology and Oceanography. 49 (3): 862–878. Bibcode:2004LimOc..49..862V. doi:10.4319/lo.2004.49.3.0862. ISSN 0024-3590. S2CID 53518458.
{{cite journal}}:|hdl-access=требует|hdl=(справка) - ↑ Mentges, A.; Feenders, C.; Deutsch, C.; Blasius, B.; Dittmar, T. (2019). Long-term stability of marine dissolved organic carbon emerges from a neutral network of compounds and microbes. Scientific Reports. 9 (1): 17780. Bibcode:2019NatSR...917780M. doi:10.1038/s41598-019-54290-z. PMC 6883037. PMID 31780725.
- ↑ Wilhelm, Steven W.; Suttle, Curtis A. (1999). Viruses and nutrient cycles in the sea: viruses play critical roles in the structure and function of aquatic food webs. BioScience. 49 (10): 781–788. doi:10.2307/1313569. JSTOR 1313569.
- ↑ Fuhrman, Jed A. (1999). Marine viruses and their biogeochemical and ecological effects. Nature. 399 (6736): 541–548. Bibcode:1999Natur.399..541F. doi:10.1038/21119. ISSN 0028-0836. PMID 10376593. S2CID 1260399.
- ↑ Wigington, Charles H.; Sonderegger, Derek; Brussaard, Corina P. D.; Buchan, Alison; Finke, Jan F.; Fuhrman, Jed A.; Lennon, Jay T.; Middelboe, Mathias; Suttle, Curtis A.; Stock, Charles; Wilson, William H. (March 2016). Re-examination of the relationship between marine virus and microbial cell abundances. Nature Microbiology (англ.). 1 (3): 15024. doi:10.1038/nmicrobiol.2015.24. ISSN 2058-5276. PMID 27572161. S2CID 52829633.
- ↑ Hays, Graeme C.; Doyle, Thomas K.; Houghton, Jonathan D.R. (2018). A Paradigm Shift in the Trophic Importance of Jellyfish?. Trends in Ecology & Evolution. 33 (11): 874–884. Bibcode:2018TEcoE..33..874H. doi:10.1016/j.tree.2018.09.001. PMID 30245075. S2CID 52336522.
- ↑ Lebrato, Mario; Pitt, Kylie A.; Sweetman, Andrew K.; Jones, Daniel O. B.; Cartes, Joan E.; Oschlies, Andreas; Condon, Robert H.; Molinero, Juan Carlos & Adler, Laetitia (2012). Jelly-falls historic and recent observations: a review to drive future research directions. Hydrobiologia. 690 (1): 227–245. doi:10.1007/s10750-012-1046-8. S2CID 15428213.
- ↑ Lebrato, M. & Jones, D. O. B. (2009). Mass deposition event of Pyrosoma atlanticum carcasses off Ivory Coast (West Africa) (PDF). Limnology and Oceanography. 54 (4): 1197–1209. Bibcode:2009LimOc..54.1197L. doi:10.4319/lo.2009.54.4.1197.
- 1 2 Sweetman, Andrew K. & Chapman, Annelise (2011). First observations of jelly-falls at the seafloor in a deep-sea fjord. Deep Sea Research Part I: Oceanographic Research Papers. 58 (12): 1206–1211. Bibcode:2011DSRI...58.1206S. doi:10.1016/j.dsr.2011.08.006.
- ↑ Burd, Adrian. Towards a transformative understanding of the ocean's biological pump: Priorities for future research-Report on the NSF Biology of the Biological Pump Workshop. OCB: Ocean Carbon & Biogeochemistry. Дата обращения: 30 октября 2016.
- ↑ Brown, Joshua E. Whale poop pumps up ocean health. Science Daily (12 октября 2010). Дата обращения: 18 августа 2014.
- ↑ Roman, Joe; McCarthy, James J. The Whale Pump: Marine Mammals Enhance Primary Productivity in a Coastal Basin (англ.) // PLOS ONE. — 2010. — Vol. . 5 (10). — P. 13255. — doi:10.1371/journal.pone.0013255. — . — PMID 20949007. — PMC 2952594.
- ↑ Longhurst, Alan R.; Glen Harrison, W. (1989). The biological pump: Profiles of plankton production and consumption in the upper ocean. Progress in Oceanography. 22 (1): 47–123. Bibcode:1989PrOce..22...47L. doi:10.1016/0079-6611(89)90010-4.
- ↑ Hutchins, David A.; Wang, Wen-Xiong; Fisher, Nicholas S. (1995). Copepod grazing and the biogeochemical fate of diatom iron. Limnology and Oceanography. 40 (5): 989–994. Bibcode:1995LimOc..40..989H. doi:10.4319/lo.1995.40.5.0989.
- ↑ Steinberg, Deborah K.; Goldthwait, Sarah A.; Hansell, Dennis A. (2002). Zooplankton vertical migration and the active transport of dissolved organic and inorganic nitrogen in the Sargasso Sea. Deep Sea Research Part I: Oceanographic Research Papers. 49 (8): 1445–1461. Bibcode:2002DSRI...49.1445S. doi:10.1016/S0967-0637(02)00037-7.
- ↑ Pershing, Andrew J.; Christensen, Line B.; Record, Nicholas R.; Sherwood, Graham D.; Stetson, Peter B. (2010). The Impact of Whaling on the Ocean Carbon Cycle: Why Bigger Was Better. PLOS ONE. 5 (8): e12444. Bibcode:2010PLoSO...512444P. doi:10.1371/journal.pone.0012444. PMC 2928761. PMID 20865156.
- ↑ Nature's Solution to Climate Change – IMF F&D. International Monetary Fund. Дата обращения: 2 ноября 2019.
- ↑ Wiebe, P.H; L.P. Madin; L.R. Haury; G.R. Harbison; L.M. Philbin (1979). Diel Vertical Migration by Salpa aspera and its potential for large-scale particulate organic matter transport to the deep-sea. Marine Biology. 53 (3): 249–255. Bibcode:1979MarBi..53..249W. doi:10.1007/BF00952433. S2CID 85127670.
- 1 2 3 4 Jónasdóttir, Sigrún Huld; Visser, André W.; Richardson, Katherine; Heath, Michael R. (29 сентября 2015). Seasonal copepod lipid pump promotes carbon sequestration in the deep North Atlantic. Proceedings of the National Academy of Sciences (англ.). 112 (39): 12122–12126. doi:10.1073/pnas.1512110112. ISSN 0027-8424. PMC 4593097. PMID 26338976.
- 1 2 3 Visser, Andre (2017-03-02). Calanus hyperboreus and the lipid pump. Limnology and Oceanography. 62 (3): 1155–1165. Bibcode:2017LimOc..62.1155V. doi:10.1002/lno.10492. S2CID 51989153.
- 1 2 3 Steinberg, Deborah K.; Landry, Michael R. (3 января 2017). Zooplankton and the Ocean Carbon Cycle. Annual Review of Marine Science. 9 (1): 413–444. Bibcode:2017ARMS....9..413S. doi:10.1146/annurev-marine-010814-015924. ISSN 1941-1405. PMID 27814033.
- ↑ Parent, Genevieve J.; Plourde, Stephane; Turgeon, Julie (1 ноября 2011). Overlapping size ranges of Calanus spp. off the Canadian Arctic and Atlantic Coasts: impact on species' abundances. Journal of Plankton Research. 33 (11): 1654–1665. doi:10.1093/plankt/fbr072. ISSN 0142-7873.
- ↑ Kristiansen, Inga; Gaard, Eilif; Hátún, Hjálmar; Jónasdóttir, Sigrún; Ferreira, A. Sofia A. (1 мая 2016). Persistent shift of Calanus spp. in the southwestern Norwegian Sea since 2003, linked to ocean climate. ICES Journal of Marine Science. 73 (5): 1319–1329. doi:10.1093/icesjms/fsv222. ISSN 1054-3139.
- ↑ Jensen, Maj Holst; Nielsen, Torkel Gissel; Dahllöf, Ingela (28 апреля 2008). Effects of pyrene on grazing and reproduction of Calanus finmarchicus and Calanus glacialis from Disko Bay, West Greenland. Aquatic Toxicology (англ.). 87 (2): 99–107. Bibcode:2008AqTox..87...99J. doi:10.1016/j.aquatox.2008.01.005. ISSN 0166-445X. PMID 18291539.
- ↑ Tanet, Lisa; Martini, Séverine; Casalot, Laurie; Tamburini, Christian. Reviews and syntheses: Bacterial bioluminescence – ecology and impact in the biological carbon pump (англ.) // Biogeosciences. — 2020. — Vol. 17 (14): 3757–3778. — .
- ↑ Kayler, Z., Janowiak, M., Swanston, C. The Global Carbon Cycle // Considering Forest and Grassland Carbon in Land Management. — United States Department of Agriculture, Forest Service, 2017. — Vol. 95. — P. 3–9. — doi:10.2737/WO-GTR-95.
- ↑ NASA. The Slow Carbon Cycle (16 июня 2011). Дата обращения: 24 июня 2012. Архивировано 16 июня 2012 года.
- ↑ Marinov, I.; Gnanadesikan, A.; Toggweiler, J. R.; Sarmiento, J. L. (2006). The Southern Ocean biogeochemical divide. Nature. 441 (7096): 964–967. Bibcode:2006Natur.441..964M. doi:10.1038/nature04883. PMID 16791191. S2CID 4428683.
- ↑ Takahashi, Taro; Sutherland, Stewart C.; Sweeney, Colm; Poisson, Alain; Metzl, Nicolas; Tilbrook, Bronte; Bates, Nicolas; Wanninkhof, Rik; Feely, Richard A.; Sabine, Christopher; Olafsson, Jon; Nojiri, Yukihiro (2002). Global sea–air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects. Deep Sea Research Part II: Topical Studies in Oceanography. 49 (9–10): 1601–1622. Bibcode:2002DSRII..49.1601T. doi:10.1016/S0967-0645(02)00003-6.
- ↑ Study reveals uncertainty in how much carbon the ocean absorbs over time (англ.). MIT News | Massachusetts Institute of Technology (5 апреля 2021). Дата обращения: 7 мая 2021.
- ↑ Parmentier, Frans-Jan W.; Christensen, Torben R.; Rysgaard, Søren; Bendtsen, Jørgen; Glud, Ronnie N.; Else, Brent; Van Huissteden, Jacobus; Sachs, Torsten; Vonk, Jorien E.; Sejr, Mikael K. (2017). A synthesis of the arctic terrestrial and marine carbon cycles under pressure from a dwindling cryosphere. Ambio. 46 (Suppl 1): 53–69. Bibcode:2017Ambio..46S..53P. doi:10.1007/s13280-016-0872-8. PMC 5258664. PMID 28116680.
 Modified text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Modified text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License. - ↑ Parmentier, Frans-Jan W.; Christensen, Torben R.; Sørensen, Lise Lotte; Rysgaard, Søren; McGuire, A. David; Miller, Paul A.; Walker, Donald A. (2013). The impact of lower sea-ice extent on Arctic greenhouse-gas exchange. Nature Climate Change. 3 (3): 195–202. Bibcode:2013NatCC...3..195P. doi:10.1038/nclimate1784.
- ↑ Orr, James C.; Fabry, Victoria J.; Aumont, Olivier; Bopp, Laurent; Doney, Scott C.; Feely, Richard A.; Gnanadesikan, Anand; Gruber, Nicolas; Ishida, Akio; et al. (2005). Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms (PDF). Nature. 437 (7059): 681–686. Bibcode:2005Natur.437..681O. doi:10.1038/nature04095. PMID 16193043. S2CID 4306199.
- ↑ Armstrong, Robert A.; Lee, Cindy; Hedges, John I.; Honjo, Susumu & Wakeham, Stuart G. (2001). A new, mechanistic model for organic carbon fluxes in the ocean based on the quantitative association of POC with ballast minerals. Deep Sea Research Part II: Topical Studies in Oceanography. 49 (1–3): 219–236. Bibcode:2001DSRII..49..219A. doi:10.1016/s0967-0645(01)00101-1.
- ↑ Bopp, L.; Aumont, O.; Cadule, P.; Alvain, S.; Gehlen, M. (2005). Response of diatoms distribution to global warming and potential implications: A global model study. Geophysical Research Letters. 32 (19): n/a. Bibcode:2005GeoRL..3219606B. doi:10.1029/2005GL023653.
- ↑ Iglesias-Rodriguez, M. D.; Halloran, P. R.; Rickaby, R. E. M.; Hall, I. R.; Colmenero-Hidalgo, E.; Gittins, J. R.; Green, D. R. H.; Tyrrell, T.; Gibbs, S. J.; von Dassow, P.; Rehm, E.; Armbrust, E. V.; Boessenkool, K. P. (2008). Phytoplankton Calcification in a High-CO2 World. Science. 320 (5874): 336–340. Bibcode:2008Sci...320..336I. doi:10.1126/science.1154122. PMID 18420926. S2CID 206511068.
- ↑ Rivero-Calle, Sara; Gnanadesikan, Anand; Castillo, Carlos E. Del; Balch, William M. & Guikema, Seth D. (2015). Multidecadal increase in North Atlantic coccolithophores and the potential role of rising CO2. Science. 350 (6267): 1533–1537. Bibcode:2015Sci...350.1533R. doi:10.1126/science.aaa8026. PMID 26612836.
- ↑ Jensen, Lasse Ørsted; Mousing, Erik Askov; Richardson, Katherine (2017). Using species distribution modelling to predict future distributions of phytoplankton: Case study using species important for the biological pump. Marine Ecology. 38 (3): e12427. Bibcode:2017MarEc..38E2427J. doi:10.1111/maec.12427.
- ↑ Nielsen, Daniel; Petrou, Katherina. Acid oceans are shrinking plankton, fueling faster climate change (амер. англ.). phys.org (27 августа 2019). Дата обращения: 7 сентября 2019.
- ↑ Brewin, Robert JW; Sathyendranath, Shubha ; Platt, Trevor; Bouman, Heather; et al. Sensing the ocean biology carbon pump from space: A review of capabilities, concepts, research gaps and future developments (англ.) // Earth-Science Reviews . 217. Elsevier BV: 103604. — 2021. — ISSN 0012-8252. — doi:10.1016/j.earscirev.2021.103604. — .
- ↑ Levin, L.A., Bett, B.J., Gates, A.R., Heimbach, P., Howe, B.M., Janssen, F., McCurdy, A., Ruhl, H.A., Snelgrove, P., Stocks, K.I., Bailey, D. and 27 others. Global observing needs in the deep ocean (англ.) // Frontiers in Marine Science. — 2019. — Vol. 6: 241. — doi:10.3389/fmars.2019.00241.