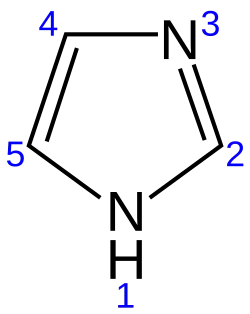
Имидазол
| Имидазол | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
1H-Имидазол 1,3-Диазациклопента-2,4-диен |
||
| Традиционные названия |
1,3-Диазол Глиоксалин (устаревшее) |
||
| Хим. формула | C3H4N2 | ||
| Физические свойства | |||
| Молярная масса | 68,08 г/моль | ||
| Плотность | 1.23 г/см³ | ||
| Энергия ионизации | 8,81 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 89-91 °C | ||
| • кипения | 256 °C | ||
| Структура | |||
| Дипольный момент | 1,3E−29 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 288-32-4 | ||
| PubChem | 795 | ||
| Рег. номер EINECS | 206-019-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | NI3325000 | ||
| ChEBI | 16069 | ||
| ChemSpider | 773 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Имидазо́л — органическое соединение класса гетероциклов, пятичленный цикл с двумя атомами азота и тремя атомами углерода в цикле, изомерен пиразолу.
Свойства
В незамещенном имидазоле положения 4 и 5 (атомы углерода) равноценны, вследствие таутомерии.
Ароматичен, реагирует с солями диазония (сочетание).
Нитруется и сульфируется только в кислой среде в положение 4, галогены в щелочной среде вступают по положению 2, в кислой — по положению 4.
Легко алкилируется и ацилируется по иминному N, раскрывает цикл при взаимодействии с растворами сильных кислот и пероксидов.
Катализирует гидролиз трудноомыляемых сложных эфиров и амидов карбоновых кислот.
На основе имидазола производят большое количество различных ионных жидкостей.
Методы получения
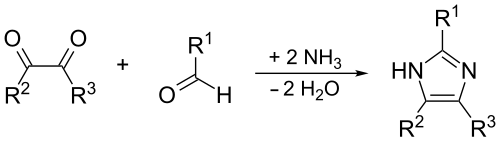
Впервые имидазол был получен Генрихом Дебюсом в 1858 г. конденсацией глиоксаля с аммиаком и формальдегидом[2], этот метод может использоваться и в синтезе замещенных имидазолов:
В лабораторной практике имидазол синтезируют декарбоксилированием 4,5-имидазолдикарбоновой кислоты, получаемой окислением бензимидазола.
Биологическая роль
Имидазольное ядро входит в состав незаменимой аминокислоты гистидина.
Структурный фрагмент гистамина, пуриновых оснований, ряда лекарственных средств (дибазол, метапрот, ксилометазолин и др.).
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5..
Примечания
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Heinrich Debus. Ueber die Einwirkung des Ammoniaks auf Glyoxal (неопр.) // Annalen der Chemie und Pharmacie. — 1858. — Т. 107, № 2. — С. 199 — 208. — doi:10.1002/jlac.18581070209.