Молибденовая кислота
| Молибденовая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Молибденовая кислота | ||
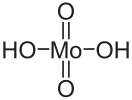
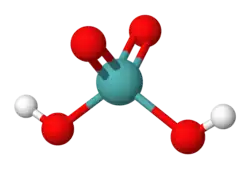
| Хим. формула | H2MoO4 | ||
| Физические свойства | |||
| Состояние | бесцветные (белые) кристаллы | ||
| Молярная масса | 161,95 г/моль | ||
| Плотность | 3,112 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | разл. 115 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,1220; 2,370 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 7782-91-4 | ||
| PubChem | 82208 | ||
| Рег. номер EINECS | 231-970-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 25371 | ||
| ChemSpider | 74188 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Молибденовая кислота — неорганическое соединение, кислородсодержащая кислота, образованная металлом молибденом с формулой H2MoO4, бесцветные (белые) кристаллы, слабо растворимые в воде, образует кристаллогидраты.
Получение
- Кристаллогидрат образуется при действии разбавленными кислотами на концентрированные растворы молибдатов щелочных металлов:
- Безводную кислоту получают концентрированием водного раствора H2MoO4•H2O при 40-70°С.
Физические свойства
Молибденовая кислота образует бесцветные (белые) кристаллы, слабо растворимые в воде.
Образует кристаллогидраты состава H2MoO4•n H2O, где n = 1 и 2.
Химические свойства
- Образует соли — молибдаты:
- Разлагается при нагревании:
Другие соединения
Известны молибденовые кислоты другого состава:
- димолибденовая кислота H2Mo2O7 или 2MoO3•H2O
- тетрамолибденовая кислота H2Mo4O13 или 4MoO3•H2O
- мезомолибденовая кислота H4MoO5 или MoO3•2H2O
- ортомолибденовая кислота H6MoO6 или MoO3•3H2O
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.