Хлорид молибдена(V)
| Хлорид молибдена(V) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Хлорид молибдена(V) |
| Традиционные названия | Хлористый молибден |
| Хим. формула | MoCl5 |
| Физические свойства | |
| Состояние | Чёрные кристаллы |
| Молярная масса | 273,21 г/моль |
| Плотность | 2,927; 2,928 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 194; 194,4 °C |
| • кипения | 268; 269 °C |
| Мол. теплоёмк. | 120 Дж/(моль·К) |
| Энтальпия | |
| • образования | -527 кДж/моль |
| Классификация | |
| Рег. номер CAS | 10241-05-1 |
| PubChem | 61497 |
| Рег. номер EINECS | 233-575-3 |
| SMILES | |
| InChI | |
| RTECS | QA4690000 |
| ChEBI | 30635 |
| Номер ООН | 2508 |
| ChemSpider | 55417 и 11178826 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид молибдена(V) — неорганическое соединение, соль металла молибдена и соляной кислоты с формулой MoCl5, чёрные гигроскопичные кристаллы, реагирует с водой.
Получение
- Реакция порошкообразного молибдена и хлора:
- Действие тетрахлорметана на оксид молибдена(VI):
Физические свойства
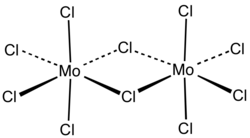
Хлорид молибдена(V) образует чёрные гигроскопичные кристаллы моноклинной сингонии, пространственная группа C 2/m, параметры ячейки a = 1,731 нм, b = 1,781 нм, c = 0,6079 нм, β = 95,7°, Z = 12.
Растворяется в диэтиловом эфире, спиртах, тетрахлорметане, хлороформе, дихлорэтане.
Химические свойства
- При сильном нагревании (в пара́х) в инертной атмосфере разлагается:
- Реагирует с влагой воздуха:
- Реагирует с водой:
- Реагирует с концентрированной горячей азотной кислотой:
- Реагирует с концентрированными щелочами:
- Окисляется при нагревании кислородом воздуха:
- Восстанавливается водородом до молибдена при 900 °C и до хлорида молибдена(III) при 250 °C:
- При восстановлении алюминием в эфирном растворе под давлением монооксида углерода образуется гексакарбонил молибдена:
- Восстанавливается иодоводородом до иодида молибдена(IV):
- При растворении в сжиженном сернистом газе образует оксохлорид:
- Восстанавливается сульфидом натрия до дисульфида молибдена:
Применение
- Получение порошков молибдена.
- Нанесение покрытия молибдена на неметаллические поверхности.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.