Хлорат лития
| Хлорат лития | |
|---|---|
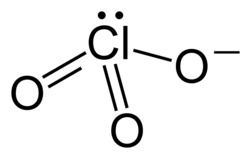 | |
| Общие | |
| Систематическое наименование |
Хлорат лития |
| Традиционные названия | Хлорноватокислый литий |
| Хим. формула | LiClO3 |
| Физические свойства | |
| Состояние | бесцветное гигроскопическое вещество |
| Молярная масса | 90,39 г/моль |
| Плотность | 2,631 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 129 °C |
| • кипения | разл. 270 °C |
| Энтальпия | |
| • образования | -368,3 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 313,518; 50027 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13453-71-9 |
| PubChem | 23682463 |
| Рег. номер EINECS | 236-632-0 |
| SMILES | |
| InChI | |
| ChemSpider | 55520 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорат лития — соль хлорноватой кислоты и лития с формулой LiClO3, бесцветное гигроскопическое вещество. Образует кристаллогидраты LiClO3•3H2O, LiClO3•H2O, LiClO3•½H2O, LiClO3•¼H2O.
Получение
- Хлорат лития получают действием хлорноватой кислоты на карбонат лития:
- или пропуская хлор через гидроксид лития:
- Из водных растворов кристаллизуется в виде кристаллогидратов LiClO3•3H2O (темп. пл. 8,5°С), LiClO3•H2O (темп. пл. 20,5°С), LiClO3•½H2O (темп. пл. 65°С), LiClO3•¼H2O (темп. пл. 42°С).
Физические свойства
Хлорат лития — бесцветное гигроскопическое вещество, аморфное или ромбические кристаллы. Очень хорошо растворяется в воде и спирте, плохо растворяется в ацетоне.
Химические свойства
- Хлорат лития — сильный окислитель, в твёрдом состоянии в смеси с углеродом, серой и другими восстановителями детонирует при нагревании или ударе.
- При нагревании разлагается до перхлората или хлорида лития в присутствии диоксида марганца в роли катализатора[1]:
Применение
- Хлорат лития нашёл незначительное применение в пиротехнике.
- Главное и очень важное применение как электролит в литиевых батарейках(в основном плоских миниатюрных батарейках 3V)
- В качество окислителя. Раньше в том числе применялся как окислитель для ракетного топлива.[2]
Литература
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5. — 783 с. — ISBN 5-85270-310-9.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия. — М.: «Химия», 1970. — 408 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Примечания
- ↑ Лидин, 2000, с. 260.
- ↑ Ernst-Christian Koch. Special Materials in Pyrotechnics: III. Application of Lithium and its Compounds in Energetic Systems (англ.) // Propellants, Explosives, Pyrotechnics. — 2004. — Vol. 29, iss. 2. — P. 67–80. — ISSN 1521-4087. — doi:10.1002/prep.200400032.