Нитрат бария
| Нитрат бария | |
|---|---|
 | |
| | |
| Общие | |
| Систематическое наименование |
Нитрат бария |
| Традиционные названия | Нитрат бария; бариевая селитра, азотнокислый барий; нитробарит |
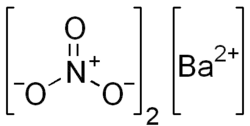
| Хим. формула | Ba(NO3)2 |
| Рац. формула | Ba(NO3)2 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 261,337 г/моль |
| Плотность | 3,24 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 595 °C |
| Мол. теплоёмк. | 151,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | −978,6 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
4,95 г/100 мл (при 0 °C) 10,5 г/100 мл (при +25 °C) 34,4 (при 100 °C) |
| • в | спирте: нерастворим |
| Классификация | |
| Рег. номер CAS | 10022-31-8 |
| PubChem | 24798 и 15243532 |
| Рег. номер EINECS | 233-020-5 |
| SMILES | |
| InChI | |
| RTECS | CQ9625000 |
| ChEBI | 190440 |
| ChemSpider | 23184 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м3 |
| ЛД50 | (перорально, крысы) 355 мг/кг |
| Токсичность | умеренно-токсичен, ирритант, опасен для окружающей среды, окислитель |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т ба́рия (в просторечии — азотнокислый ба́рий, ба́риевая селитра, динитра́т ба́рия) — неорганическое соединение, бариевая соль азотной кислоты. Химическая формула — Ba(NO3)2.
Распространение в природе
Нитрат бария встречается в природе в виде редкого минерала нитробаритa.
Физико-химические свойства
Нитрат бария представляет собой бесцветные кристаллы с кубической решеткой.
Термодинамические параметры
- Энтропия образования (298К): 96,4 Дж/(моль·К)
- Энтальпия плавления: 53,1 кДж/моль
Растворимость
- В воде
- растворим (9,2 г/100мл при +20 °C; 34,2 г/100мл при +100 °C);
- не растворим в спирте и концентрированной азотной кислоте.
С нитратом калия образует Ba(NO3)2•2KNO3.
Методы получения
- В лаборатории методом получения нитрата бария является взаимодействие гидроксида бария с азотной кислотой:
- В промышленности обычно используют для этих целей BaCO3:
Химические свойства
- В водном растворе подвергается диссоциации:
- При температуре выше 595 °C разлагается до нитрита:
-
- При температуре свыше 670 °C разлагается до оксида бария:
- При температуре свыше 670 °C разлагается до оксида бария:
- В водном растворе реагирует с серной кислотой и сульфатами с выпадением белого осадка сульфата бария:
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата бария с некоторыми органическими материалами склонны к самовоспламенению.
- Ионы бария образуют устойчивые соединения с краун-эфирами.
Применение
- Для получения оксида и пероксида бария.
- Компонент эмалей и глазурей.
- В пиротехнике негигроскопичный нитрат бария широко используется для окрашивания пламени в зелёный цвет (большинство соединений других металлов, способных на это, мало пригодны из-за гигроскопичности).
- В специальных пулях к стрелковому оружию как окислитель в зажигательных и трассирующих составах.
Физиологическое значение
- Нитрат бария обладает умеренно-токсическим действием. ЛД50 для крыс при пероральном введении составляет 355 мг на 1 кг живого веса.
- Предельно допустимая концентрация азотнокислого бария в воздухе рабочих помещений составляет 0,5 г/см3[2] с обязательным контролем по ионам бария[3][4].
- Передозировка нитрата бария и других соединений этого металла в живых организмах - небезопасна.
Примечания
- ↑ ICSC 1480 - НИТРАТ БАРИЯ. www.ilo.org. Дата обращения: 30 июня 2020. Архивировано 30 июня 2020 года.
- ↑ name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 3777-76 Барий азотнокислый. Технические условия (с Изменениями 1, 2)
- ↑ name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 1713-79 Барий азотно-кислый технический. Технические условия (с Изменениями N 1, 2, 3)
- ↑ name=https://www.safework.ru Архивная копия от 8 марта 2022 на Wayback Machine

