Нитрат кадмия
| Нитрат кадмия | |
|---|---|
 | |
| | |
| Общие | |
| Систематическое наименование |
Cadmium(II) nitrate |
| Традиционные названия | Nitric acid, cadmium salt |
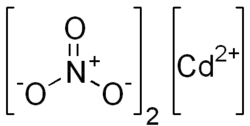
| Хим. формула | CdN2O6 |
| Рац. формула | Cd(NO3)2 |
| Физические свойства | |
| Состояние | белые кристаллы |
| Молярная масса | 236.42 г/моль |
| Плотность | 3.6 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 350 °C |
| Химические свойства | |
| Растворимость | |
| • в | 327 г (в 100 г воды) (при 15 град) |
| • в | растворяется в кислотах |
| Классификация | |
| Рег. номер CAS | 10022-68-1 |
| PubChem | 25154 |
| Рег. номер EINECS | 233-710-6 |
| SMILES | |
| InChI | |
| ChEBI | 77732 |
| Номер ООН | 3087 |
| ChemSpider | 23498 и 21489469 |
| Безопасность | |
| ЛД50 | (орально, крысы) 300 мг/кг |
| Токсичность | среднетоксичен |
| Фразы риска (R) | R20/21/22, R50/53 |
| Фразы безопасности (S) | S60, S61 |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитра́т ка́дмия (англ. Cadmium nitrate) — химическое вещество с формулой Cd(NO3)2. Представляет собой белое кристаллическое твёрдое вещество, обладающее гигроскопическими свойствами. Является канцерогеном.
Использование
Нитрат кадмия используется в производстве цветного стекла, а также в фотографии. Иногда — как источник ионов кадмия для растворов.
Получение
Нитрат кадмия может быть получен растворением металлического кадмия, его оксида, гидроксида или карбоната в азотной кислоте:
- CdO + 2HNO3 → Cd(NO3)2 + H2O
Свойства
При нагревании вещество разлагается на оксид кадмия и смесь оксидов азота. При пропускании сероводорода через подкисленный раствор вещества образуется жёлтый сульфид кадмия (н.у.); при нагревании сульфид приобретает красный цвет.
Взаимодействуя с гидроксидом натрия, вещество образует гидроксид кадмия; по реакции нитрата с другими солями получают нерастворимые в воде соединения кадмия[1].
Примечания
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8

