Фторид хлора(I)
| Фторид хлора(I) | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Фторид хлора(I) | ||
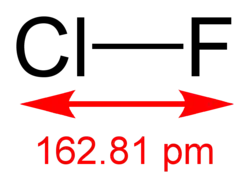
| Хим. формула | ClF | ||
| Физические свойства | |||
| Состояние | бледно-жёлтый газ | ||
| Молярная масса | 54,45 г/моль | ||
| Плотность | (жидкость, −100 °C) 1,62 г/см³ | ||
| Энергия ионизации | 12,65 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −155,6 °C | ||
| • кипения | −100,1 °C | ||
| Структура | |||
| Дипольный момент | 3,0E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 7790-89-8 | ||
| PubChem | 123266 | ||
| Рег. номер EINECS | 232-229-9 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30121 | ||
| ChemSpider | 109879 | ||
| Безопасность | |||
| Токсичность | ядовит, сильный окислитель | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фтори́д хло́ра(I) (монофтори́д хло́ра, однофто́ристый хлор, хим. формула — ClF) — неорганическое бинарное соединение хлора с фтором.
Простое вещество фторид хлора(I) — бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до −100 °C в жидкость бледно-жёлтого цвета. Многие свойства сходны со свойствами фтора и хлора.
Физико-химические свойства
| Свойство | Значение |
|---|---|
| Диэлектрическая проницаемость | 0,881 |
| Стандартная энтальпия образования (298 К, в газовой фазе) | −56,5 кДж/моль |
| Энтропия образования (298 К, в газовой фазе) | 217,91 Дж/(моль·К) |
| Энтальпия парообразования | 20,16 кДж/моль |
| Теплоёмкость (298К, в газовой фазе) | 32,22 Дж/(моль·К) |
В ИК-спектрах наблюдается полоса поглощения 747 см−1 (для твёрдого вещества).
Методы получения
- Одним из методов получения фторида хлора является метод, предложенный Доманжем и Хейдорфером[2]. В этом методе через аппарат, состоящий из медных трубок, пропускают смесь хлора и фтора в соотношении 1:1 при 220—230 °C:
- Cl2 + F2 → 2ClF
- ClF также получают из трифторида хлора и хлора. Так как в настоящее время трифторид хлора производится в промышленном масштабе, то этот метод получил большое распространение:
- ClF3 + Cl2 → 3 ClF
Химические свойства
Химически очень активное вещество; по своей активности в некоторых реакциях превосходит фтор. Хороший фторирующий агент. За счёт того, что атом хлора находится в степени окисления +1, проявляет сильные окислительные свойства.
- 4ClF + 2H2O → 2Cl2 + O2 + 4HF
- При нагревании очень активно реагирует с водородом. При этом образуются фтороводород и хлороводород:
- ClF + H2 → HCl + HF
- Реагирует с хлоридами металлов с образованием фторидов и хлора:
- NaCl + ClF → NaF + Cl2
- При взаимодействии с простыми веществами образуются фториды:
- Br2 + 6ClF → 2BrF3 + 3Cl2
- Si + 4ClF → SiF4 + 2Cl2
- W + 6ClF → WF6 + 3Cl2
- С монооксидом углерода проходит реакция хлорфторирования:
- CO + ClF → COClF
- CsF + ClF → CsClF2
- Необычное полимерное соединение фиолетового цвета состава (F3ClO2)n было получено при взаимодействии ClF и O2F2:
- nClF + nO2F2 → (F3ClO2)n
Применение
- Применяется как фторирующий агент в органическом синтезе[3], а также как хлорирующий агент[4][5].
- Также достаточно перспективно использование монофторида хлора для очистки фторидов урана[6]:
- 4ClF + UO2F2 → O2 + 2Cl2 + UF6
Токсичность
Фторид хлора(I) весьма ядовит, обладает удушающим действием (СДЯВ). Как и все интергалогены, является сильным окислителем. ПДК в рабочей зоне — 0,5 мг/м³.
Литература
- Николаев Н. С., Сухоруков В. Ф., Шишков Ю. Д., Аленчикова И. Ф. Химия галоидных соединений фтора. — М.: Наука, 1968, с. 344.
Примечания
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ L. Domange, S. Heudorffer Compt. rend. 1948, V. 226., P. 920.
- ↑ Богуславская Л. С. Фториды галогенов в органическом синтезе // Успехи химии. — 1984. — Т. 53, вып. 12. — С. 2024—2055.
- ↑ Shellhamer D. F., Titterington P. K. Heasley V. L. Symmetry of chloronium ions from ionic reaction of chlorine, chlorine monofluoride gas, and chlorine monofluoride complex with terminal alkenes (англ.) // Journal of Fluorine Chemistry. — 2003. — Vol. 124, iss. 1. — P. 17—20. — doi:10.1016/S0022-1139(03)00169-6. Архивировано 30 ноября 2020 года.
- ↑ Gambaretto G. P., Napoli M. The reactions of chlorine monofluoride with unsaturated compounds and the dehydrohalogenation of some of the derivatives (англ.) // Journal of Fluorine Chemistry. — 1976. — Vol. 7, iss. 6. — P. 569—580. — doi:10.1016/S0022-1139(00)82473-2.
- ↑ Shrewsberry R. C., Williamson E. L. Chemistry of the chlorine trifluoride-uranyl fluoride reaction (англ.) // Journal of Inorganic and Nuclear Chemistry. — 1966. — Vol. 28, iss. 11. — P. 2535—2539. — doi:10.1016/0022-1902(66)80377-9.