Оксид хлора(VII)
| Оксид хлора(VII) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Оксид хлора(VII) | ||
| Хим. формула | Cl2O7 | ||
| Рац. формула | Cl2O7 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 182.901 г/моль | ||
| Плотность | 1,9 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −91,5 °C | ||
| • кипения | 82 °C | ||
| • разложения | 120 °C | ||
| Энтальпия | |||
| • образования | 251,0 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | [12015-53-1] | ||
| PubChem | 123272 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 52356 | ||
| ChemSpider | 109884 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
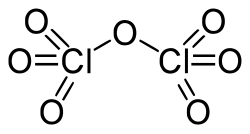
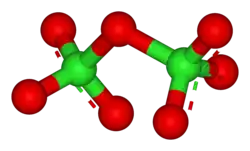
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид. Высший оксид хлора, в котором он проявляет степень окисления +7.
Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0,1709 нм, в группах ClО3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C2, молекула полярна (μ = 2,40⋅10−30 Кл·м).
Химические свойства
Хлорный ангидрид представляет собой бесцветную маслянистую ядовитую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:
- ΔH = 135 кДж/моль
Медленно растворяется в холодной воде, образуя хлорную кислоту:
Хлорный ангидрид является сильным окислителем, к примеру, окисляет иод до его пентаоксида[1]:
Может вызвать самовоспламенение горючих веществ.
Получение
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Нагрев сухих хлоратов металлов с жидким фторидом кислорода:
Примечания
- ↑ Лидин, 2000, с. 257.
Литература
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.