Оксид лития
| Оксид лития | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Оксид лития |
| Традиционные названия | Окись лития |
| Хим. формула | Li2O |
| Рац. формула | Li2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1570 [1] |
| • кипения | 2600 [1] °C |
| Энтальпия | |
| • образования | -595,8 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 6,67 (0 °C) |
| Классификация | |
| Рег. номер CAS | 12057-24-8 |
| PubChem | 166630, 168333299 и 139036513 |
| Рег. номер EINECS | 235-019-5 |
| SMILES | |
| InChI | |
| RTECS | OJ6360000 |
| ChemSpider | 145811 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д ли́тия (окись лития) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Описание
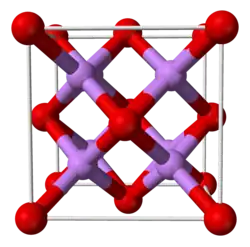
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов даёт оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).[2]
Получение
- Взаимодействие металлического лития с кислородом:
- Разложение пероксида лития при температуре 195 °C:
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
- с кислотами:
- литий из оксида вытесняется некоторыми металлами и неметаллами:
- с кислотообразующими оксидами образует соли:
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твёрдофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
Основное применение оксид лития нашёл в производстве литий-ионных аккумуляторов, в качестве источника ионов катода.
