Фторид хлора(III)
| Фторид хлора(III) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Трифторид хлора | ||
| Хим. формула | ClF3 | ||
| Рац. формула | ClF3 | ||
| Физические свойства | |||
| Состояние | бесцветный тяжёлый газ или жидкость | ||
| Молярная масса | 92,45 г/моль | ||
| Плотность | 1,77 ± 0,01 г/см³[1] | ||
| Энергия ионизации | 13 ± 1 эВ[1] и 12,65 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −76,3 °C | ||
| • кипения | 11,75 °C | ||
| • разложения | 180 °C | ||
| Энтальпия | |||
| • образования | −164,60 кДж/моль | ||
| Давление пара | 1,4 ± 0,1 атм[1] | ||
| Структура | |||
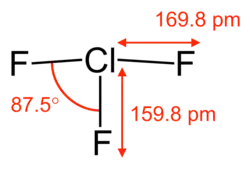
| Дипольный момент | 2,0E−30 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 7790-91-2 | ||
| PubChem | 24637 | ||
| Рег. номер EINECS | 232-230-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | FO2800000 | ||
| ChEBI | 30123 | ||
| Номер ООН | 1749 | ||
| ChemSpider | 23039 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м³ | ||
| Токсичность | Чрезвычайно токсичен, СДЯВ | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фтори́д хло́ра(III) (трифтори́д хло́ра, трёхфто́ристый хлор) — ClF3, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный, чрезвычайно ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до 12 °C (или при увеличении давления) в жидкость бледно-зелёного цвета.
Химические свойства
Сильный окислитель. Бурно реагирует (иногда со взрывом) с большинством органических и неорганических соединений, в частности с водой. Способен воспламенять стекло, поэтому для работы с ним используют посуду из фторопласта или монель-металла.
Получение
- Один из продуктов взаимодействия хлора с фтором при нагревании:
- Разложение монофторида хлора[3]:
Применение
Применяется как фторирующий агент. Исследовался в качестве химического оружия и окислителя для ракетного топлива.
Токсичность
Трифторид хлора очень ядовит и агрессивен, сильный окислитель. Обладает удушающим действием.
Примечания
- 1 2 3 http://www.cdc.gov/niosh/npg/npgd0117.html
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Лидин, 2000, с. 263.
Литература
- Николаев Н. С., Суховерхов В. Ф., Шишков В. Д., Аленчикова И. Ф. Химия галоидных соединений фтора. М.: Наука, 1968, с. 32—98.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.