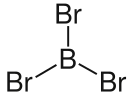
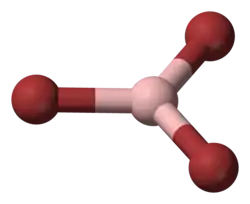
Трибромид бора
| Трибромид бора | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Бромид бора | ||
| Хим. формула | BBr3 | ||
| Рац. формула | BBr3 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 250,522 г/моль | ||
| Плотность | 2,65 г/см³ | ||
| Энергия ионизации | 9,7 эВ[1] и 10,51 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -46 °C | ||
| • кипения | 91 °C | ||
| Давление пара | 5.3 кПа при 14°C | ||
| Оптические свойства | |||
| Показатель преломления | 1,312[3] | ||
| Структура | |||
| Дипольный момент | 0 Кл·м[4] | ||
| Классификация | |||
| Рег. номер CAS | 10294-33-4 | ||
| PubChem | 25134 | ||
| Рег. номер EINECS | 233-657-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | ED7400000 | ||
| Номер ООН | 2692 | ||
| ChemSpider | 23479 | ||
| Безопасность | |||
| Предельная концентрация | 2 мг/м³ | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Трибромид бора (BBr3) — неорганическое соединение, бесцветная или слегка желтоватая жидкость. Соединение очень нестабильное, дымится на воздухе, активно реагирует с водой с образованием борной кислоты и бромоводорода, при смешивании с метанолом на воздухе последний загорается.
Получение
Обычно получают нагреванием оксида бора и углерода с добавлением брома — это высвобождает свободный бор, который активно реагирует с бромом. Впервые был получен в 1846 году взаимодействием карбида бора и брома при температуре выше 300 °C. Полученный продукт может быть очищен вакуумной дистилляцией:
Другой способ получения заключается в прямом взаимодействии бора с парами брома при температуре порядка 800 °C:
Известны также косвенные методы получения — путём взаимодействия борфтористого калия с бромидом алюминия в расплаве или реакцией газообразного трифторида бора с расплавом бромида алюминия:
Химические свойства
- Трибромид бора активно реагирует с водой. Продуктами этой реакции являются борная кислота и бромоводород:
- Трибромид бора реагирует с сероводородом с образованием тиоборной кислоты и бромоводорода:
Применение
Используется для деметилирования и деалкилирования. Применяется в фармакологии, электронике.
Токсикология
Предельно допустимая концентрация трёхбромистого бора в воздухе рабочей зоны составляет 2 мг/м³.
Относится к «умеренно-опасным» веществам (III класс токсичности).
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0061.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 4—137. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 15—14. — ISBN 978-1-4822-0868-9