Бромид меди(I)
| Бромид меди(I) | |
|---|---|
 | |
-bromide-sample.jpg) | |
| Общие | |
| Систематическое наименование |
Бромид меди(I) |
| Традиционные названия | бромистая медь |
| Хим. формула | CuBr |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 143,45 г/моль |
| Плотность | 4,72 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 504 °C |
| • кипения | 1350 °C |
| Мол. теплоёмк. | 71,9 Дж/(моль·К) |
| Энтальпия | |
| • образования |
в газовой фазе: 120 кДж/моль; в твёрдой фазе: −105 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,2⋅10−3 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 2,09 |
| Классификация | |
| Рег. номер CAS | 7787-70-4 |
| PubChem | 24593 |
| Рег. номер EINECS | 232-131-6 |
| SMILES | |
| InChI | |
| ChemSpider | 22995 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Броми́д ме́ди(I) — неорганическое вещество с формулой CuBr, соединение меди и брома. Относится к классу бинарных соединений, может рассматриваться как соль одновалентной меди и бромоводородной кислоты. В чистом виде — белое кристаллическое вещество, примеси бромида меди(II) окрашивают его в зеленоватый цвет.
Физические свойства
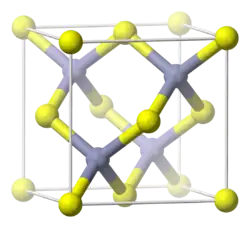
В чистом виде представляет собой бесцветные тетраэдрические микрокристаллы. Кристаллическая решётка типа сфалерита (кубическая сингония).
Во влажном воздухе на свету медленно окисляется, приобретая зеленоватый цвет. Термически устойчив: плавится и кипит без разложения. Нерастворим в воде, этаноле, эфире. Не образует кристаллогидраты.[1]
Химические свойства
Образование растворимых соединений
Бромид меди(I) растворяется в горячей концентрированной серной кислоте:
За счёт комплексообразования растворяется в концентрированных растворах бромоводородной кислоты, бромида калия, цианида калия, аммиака:
Прочие реакции
При кипячении водной суспензии бромида меди(I) происходит дисмутация последнего на бромид меди(II) и металлическую медь:
Бромид меди(I) медленно окисляется на свету во влажном воздухе:
Образует молекулярные аддукты с основаниями Льюиса, например с диметилсульфидом:
Получение
Бромид меди(I) можно получить одним из следующих способов.
Термическим разложением бромида меди(II):
Реакцией оксида меди(I) с разбавленной бромоводородной кислотой:
Восстановлением растворимых солей двухвалентной меди диоксидом серы в присутствии растворимых бромидов, например:
Пропусканием газообразного бромоводорода через суспензию металлической меди в эфире с последующим разложением образовавшегося дибромокупрата(I) водорода:
Восстановлением растворимых солей двухвалентной меди металлической медью в присутствии бромида калия с последующим разложением образовавшегося дибромокупрата(I) калия:
Применение
Бромид меди(I) применяется в органическом синтезе.
См. также
Примечания
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 142. — 637 с. — ISBN 978-5-358-01303-2.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.