Бутадиен
| Бутадиен | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
бута-1,3-диен | ||
| Традиционные названия | дивинил, бутадиен | ||
| Хим. формула | C4H6 | ||
| Физические свойства | |||
| Молярная масса | 54,09 г/моль | ||
| Плотность | 0,6211 (при температуре кипения) | ||
| Энергия ионизации | 9,07 эВ[1][2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −108,9 °C | ||
| • кипения | −4,41 °C | ||
| • вспышки | −105 ℉[1] | ||
| Пределы взрываемости | 2 об.%[1] | ||
| Давление пара | 243 180 Па[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,735 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,4292 | ||
| Структура | |||
| Дипольный момент | 0 Кл·м[2] | ||
| Классификация | |||
| Рег. номер CAS | 106-99-0 | ||
| PubChem | 7845 | ||
| Рег. номер EINECS | 203-450-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | EI9275000 | ||
| ChEBI | 39478 | ||
| ChemSpider | 7557 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бутадие́н-1,3 (дивини́л, бу́та-1,3-дие́н) — ненасыщенный углеводород, простейший представитель сопряжённых диеновых углеводородов.
Физические свойства
Бутадиен — газ с характерным неприятным запахом. Малорастворим в воде, хорошо растворим в бензоле, диэтиловом эфире, плохо растворим в метаноле и этаноле.
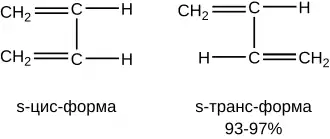
Молекулы 1,3-бутадиена могут находиться в s-цис- и s-транс-конформациях, причём последняя является преобладающей (93—97 %):
Химические свойства
Бутадиен склонен к полимеризации, легко окисляется воздухом с образованием перекисных соединений, ускоряющих полимеризацию. В воздухе с концентрацией 1,6—10,8 % об. образует взрывоопасную смесь.
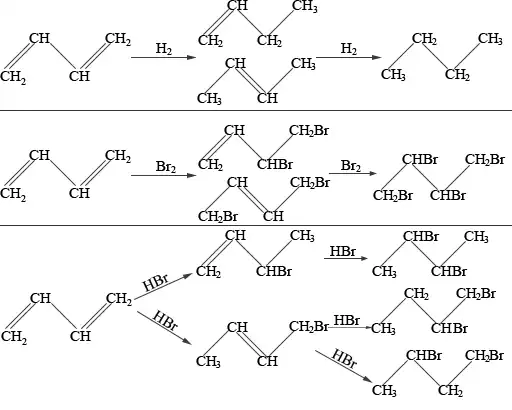
1,3-бутадиен является типичным бутадиеновым углеводородом и обладает высокой реакционной способностью. Легко вступает в реакции полимеризации, в том числе с другими непредельными соединениями — реакции сополимеризации (стиролом, эфирами и нитрилами акриловой и метакриловой кислот, изопреном, изобутиленом и др.). По двойной связи бутадиен присоединяет молекулы водорода, галогенов и галогеноводородов.
Получение
Бутадиен можно синтезировать по реакции, изученной Сергеем Лебедевым пропусканием этилового спирта через катализатор из оксидов металлов при температуре 400—450 °C[3]:
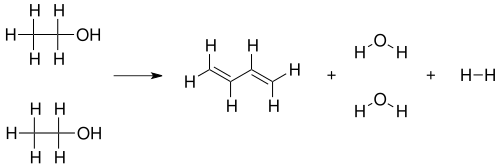
2 CH3CH2OH → CH2=CH−CH=CH2 + 2 H2O + H2
Другой способ получения бутадиена с использованием в качестве сырья этилового спирта — реакция, предложенная Иваном Остромысленским, взаимодействием уксусного альдегида (ацетальдегида) и этилового спирта на пористом катализаторе, покрытым танталом[3] при температуре 325—350 °C, сам ацетальдегид получают также из этилового спирта на предварительной стадии:
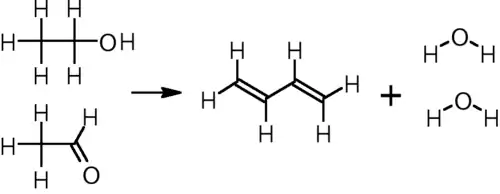
CH3CH2OH + CH3CHO → CH2=CH−CH=CH2 + 2 H2O
Оба способа теперь в промышленности применяются ограниченно, в нефтехимической промышленности основной способ получения бутадиена — дегидрирование бутана на оксидных алюмохромовых катализаторах либо его пиролиз:
Применение
- Полимеризацией бутадиена получают синтетические каучуки.
- Сополимеризацией бутадиена с акрилонитрилом и стиролом получают АБС-пластик.
См. также
Примечания
- 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0067.html
- 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- 1 2 Kirshenbaum, I. (1978). Butadiene. In M. Grayson (Ed.), Encyclopedia of Chemical Technology, 3rd ed., vol. 4, pp. 313—337. New York: John Wiley & Sons.
Литература
- Абляционные материалы — Дарзана // Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1988. — Т. 1. — 623 с.
