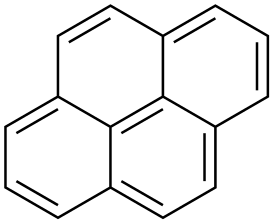
Пирен
| Пирен | |
|---|---|
 | |
| Общие | |
| Хим. формула | C16H10 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 202,25 г/моль |
| Энергия ионизации | 7,41 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 145—148 °C |
| • кипения | 400—404 °C |
| Химические свойства | |
| Растворимость | |
| • в бензоле | растворим |
| • в хлороформе | растворим |
| Классификация | |
| Рег. номер CAS | 129-00-0 |
| PubChem | 31423 |
| Рег. номер EINECS | 204-927-3 |
| SMILES | |
| InChI | |
| RTECS | UR2450000 |
| ChEBI | 39106 |
| ChemSpider | 29153 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пире́н — химическое соединение с формулой C16H10, конденсированный полициклический ароматический углеводород. При обычных условиях — белое кристаллическое вещество. При длительном хранении желтеет из-за образования продуктов окисления.
Получение и свойства
Впервые пирен был получен из каменного угля, в котором его содержание может достигать 2 %.
Пирен образуется в результате различных процессов горения. Так, например, при работе двигателя внутреннего сгорания легкового автомобиля образуется около 1 мкг этого соединения на 1 км пробега[2].
Химические свойства
При окислении соединениями хрома(VI), например, хроматами, образуется перинафтенон, а затем нафталин-1,4,5,8-тетракарбоновая кислота.
Пирен гидрируется и склонен к галогенированию и нитрованию—реакциям электрофильного замещения, вступает в реакцию Дильса — Альдера с разной степенью селективности по выходу продуктов реакции[2][3]. Бромирование происходит в одно из трех положений[4].
При восстановлении металлическим натрием образуется анион-радикал, из которого далее можно получить множество ароматических комплексов с пи-связью[5].
Источники
- [www.xumuk.ru/encyklopedia/2/3328.html Пирен]. — информация о соединении на сайте ХиМиК.ру.
Примечания
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- 1 2 Selim Senkan and Marco Castaldi «Combustion» in Ullmann’s Encyclopedia of Industrial Chemistry, 2003 Wiley-VCH, Weinheim. Article Online Posting Date: March 15, 2003.
- ↑ Senkan, Selim and Castaldi, Marco (2003) "Combustion" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- ↑ Gumprecht, W. H. (1968). 3-Bromopyrene. Org. Synth. 48: 30. doi:10.15227/orgsyn.048.0030.
- ↑ Kucera, Benjamin E.; Jilek, Robert E.; Brennessel, William W.; Ellis, John E. (2014). Bis(pyrene)metal complexes of vanadium, niobium and titanium: Isolable homoleptic pyrene complexes of transition metals. Acta Crystallographica Section C Structural Chemistry. 70 (8): 749–753. doi:10.1107/S2053229614015290. PMID 25093352.
