Хлорат натрия
| Хлорат натрия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Хлорат натрия |
| Традиционные названия | Хлорноватокислый натрий |
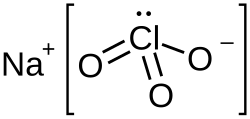
| Хим. формула | NaClO3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 106,44 г/моль |
| Плотность | 2,490; 2,493 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 255; 261; 263 °C |
| • кипения | разл. 390 °C |
| Мол. теплоёмк. | 100,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | -358 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 100,525; 204100 г/100 мл |
| • в этилендиамине | 52,8 г/100 мл |
| • в диметилформамиде | 23,4 г/100 мл |
| • в моноэтаноламине | 19,7 г/100 мл |
| • в ацетоне | 0,094 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7775-09-9 |
| PubChem | 516902 |
| Рег. номер EINECS | 231-887-4 |
| SMILES | |
| InChI | |
| RTECS | FO0525000 |
| ChEBI | 65242 |
| Номер ООН | 1495, 2428 |
| ChemSpider | 22895 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорат натрия — неорганическое соединение, соль металла натрия и хлорноватой кислоты с формулой NaClO3, бесцветные кристаллы, хорошо растворимые в воде.
Получение
- Хлорат натрия получают действием хлорноватой кислоты на карбонат натрия:
- или пропуская хлор через концентрированный раствор гидроксида натрия при нагревании:
- Электролиз водных растворов хлорида натрия без диафрагмы:
Физические свойства
Хлорат натрия — бесцветные кристаллы кубической сингонии, пространственная группа P 213, параметры ячейки a = 0,6568 нм, Z = 4.
При 230—255°С переходит в другую фазу, при 255—260°С переходит в моноклинную фазу.
Химические свойства
Хлорат натрия - реакционноспособное химическое соединение, для которого характерны многочисленные окислительно-восстановительные реакции:
- При высокой температуре соединение разлагается с выделением кислорода:
- Данная реакция происходит, когда хлорат натрия используется в качестве химического генератора кислорода.
- Диспропорционирует при нагревании (указана реакция в присутствии катализатора):
- Под действием слабых восстановителей образует диоксид хлора (IV):
- Водные растворы хлората натрия вступают в реакции с солями многих переходных металлов, переводя их в натриевые соли соответствующих металлосодержащих кислот:
- Хлорат натрия, как сильный окислитель, в твёрдом состоянии в смеси с углеродом, серой, сахарозой и другими восстановителями огне- и взрывоопасен; может сдетонировать при нагревании или ударе.
Применение
- В пиротехнике.
- Дефолиант.
- В целлюлозно-бумажной промышленности используется для производства диоксида хлора, отбеливателя целлюлозы.
- В авиации в системе аварийной подачи кислорода[1].
См. также
Примечания
- ↑ Откуда берется кислород в самолете? Дата обращения: 4 апреля 2022. Архивировано 8 июня 2017 года.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
