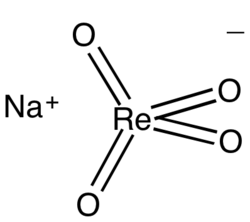
Перренат натрия
| Перренат натрия | |
|---|---|
 | |
| | |
| Общие | |
| Систематическое наименование |
Перренат натрия |
| Традиционные названия | Рениевокислый натрий |
| Хим. формула | NaReO4 |
| Физические свойства | |
| Состояние | бесцветные (белые) кристаллы |
| Молярная масса | 273,19 г/моль |
| Плотность | 5,24 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 414 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 103,30; 145,330; 17350 г/100 мл |
| • в этаноле | 22,4220 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13472-33-8 |
| PubChem | 5107658 |
| Рег. номер EINECS | 236-742-9 |
| SMILES | |
| InChI | |
| RTECS | WD3675000 |
| ChemSpider | 4282939 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Перренат натрия — неорганическое соединение, соль щелочного металла натрия и рениевой кислоты с формулой NaReO4, бесцветные (белые) кристаллы, хорошо растворимые в воде.
Получение
- Растворение оксида рения(VII) в растворе едкого натра:
- Растворение рениевой кислоты в растворе едкого натра:
Физические свойства
Перренат натрия образует бесцветные (белые) кристаллы тетрагональной сингонии, пространственная группа I 41/a, параметры ячейки a = 0,5362 нм, c = 1,1718 нм, Z = 4.
Хорошо растворим в воде и этаноле.
Химические свойства
В отличие от перманганата натрия, перренат устойчив в щелочной среде и характеризуется слабыми окислительными свойствами, которые проявляются лишь в кислой среде под действием сильных восстановителей, например, солей олова(II), титана(III), гипофосфитов.
Ранее считалось, что при действии на подкисленный раствор перрената натрия сероводорода или тиосульфата натрия в осадок выпадает чёрный сульфид рения(VII), однако в 2022 году было доказано, что осадок содержит полисульфид рения(V) [1]
Примечания
- ↑ Н.Б. Егоров, Е.А. Исаева. Исследование состава гептасульфида рения, полученного различными способами // Неорганические материалы : журнал. — 2022. — 1 сентября (т. 58, № 9). — С. 931-937.
Литература
- Справочник химика / Редкол.: Никольский Б. П. и др. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б. П. и др. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1985. — Т. 5. — 360 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.